Сегодня читаем про самый простой, самый доступный и самый действенный антисептик — про гипохлорит натрия (он же «Белизна»). Совместимость с различными материалами, техника безопасности, свойства и эффективность не только против коронавируса, но и против страшной плесени и ее микотоксинов. В качестве «вишенки» — контрольная закупка магазинных отбеливателей и оценка их состава. Чтобы узнать как в эпоху пандемии нас дурят производители бытовой химии и прочий «менеджерский брат» — идем под кат. И обязательно закидываем в закладки. Эта информация пригодится еще не раз ;)

Важно! Информацию, предложенную в данной статье вы не найдете больше ни на одном русскоязычном ресурсе. Поэтому публикую на хабре, на портале высшего пользовательского доверия. Просьба ко всем ресурсам сомнительного качества — давайте ссылку на первоисточник. Не переписывайте без понимания — не плодите бесполезный информационный шум, от которого в последнее время уже и так некуда деться. Разномастному «ученому люду» тоже рекомендую не стесняться писать в своих «методических указаниях» ссылку на хабр. Я то вижу откуда вы все копируете, книгами 50-60 годов вечно прикрываться не получится ;)
Предисловие от автора. Смотрю колонку «сейчас читают» на хабре и с сожалением вижу, что принцип «пока гром не грянет — мужик не перекрестится» работает даже здесь. Один сплошной коронавирус. И вспоминается сразу мне моя статья, опубликованная в конце января (Коронавирус 2019-nCoV. FAQ по защите органов дыхания и дезинфекции) у которой 30% минусов были с пометкой «не соответствует тематике Хабра». Соответствовать, видимо, начинает лишь тогда, когда указание сверху поступит…
Ладно, чего о грустном говорить. Если пару тысяч читателей еще тогда, в январе, без паники и спешки, смогли купить себе СИЗ и нужные антисептики — можно считать, что цель моя достигнута. А сейчас просто вольюсь в тренд и расскажу про самый простой, доступный и очень эффективный антисептик. Не думаю, что он когда-то сможет исчезнуть так же как исчез этанол. Сырья хватает, гипохлорит натрия можно производить до тех пор, пока существует электричество…
Есть такая интересная (интересная не только для химика, но и для других специалистов владеющих английским языком) книга — 100 самых важных химических соединений: Cправочное руководство (The 100 Most Important Chemical Compounds: A Reference Guide). В этом руководстве в разделе солей натрия находятся рядом пищевая сода, карбонат натрия, поваренная соль, гидроксид натрия (средство «Крот») и гипохлорит натрия. В принципе, понятно чем многие из этих солей заслужили такое право. А вот на гипохлорите натрия я остановлюсь сегодня подробнее. Первым делом, конечно же определение:
Гипохлорит натрия представляет собой химическое соединение с формулой NaOCl или NaClO, включающее катион натрия (Na+) и гипохлоритный анион (OCl- или ClO-). Это соединение можно рассматривать как соль неустойчивой хлорноватистой кислоты. Гипохлорит натрия чаще всего встречается в виде бледно-зеленовато-желтого разбавленного раствора, который с 18-го века используется в качестве отбеливающего, а позднее и дезинфицирующего средства. Стоит отметить, что гипохлорит натрия можно считать в некотором роде эндогенным для человека веществом, так как клетки-нейтрофилы иммунной системы человека производят небольшое количество этого вещества внутри фагосом, которые «переваривают» бактерии и вирусы.
С момента своего открытия в 1787 году химиком Клодом Луи Бертолле (тем самым, которому мы должны быть благодарны за хлопушки, спичечные головки, салюты и проч. изобретения, где используется т.н. бертолетова соль) гипохлорит натрия достаточно долго выступал сугубо как отбеливающий агент и только примерно с середины 19 века началось его шествие как дезинфектанта. Поэтому пройдусь немного по химическим свойствам, сохраняя «историческую хронологию».
Хлорочка как отбеливатель
Отбеливающий эффект гипохлорита — это целиком и полностью заслуга неустойчивой хлорноватистой кислоты. Ибо эта HOCl является очень сильным окислителем (даже сильнее, чем газообразный Cl2) и может реагировать и разрушать многие типы молекул, включая красители. В водной среде гипохлорит натрия NaOCl обратимо гидролизуется с образованием хлорноватистой кислоты и щелочи:
NaOCl + H2O → HOCl + NaOH
В свою очередь хлорноватистая кислота HOCl распадается на атомарный кислород (O*) и соляную кислоту:
HOCl → HCl + O*
Ну а атомарный кислород — очень ядреная штука, мощнейший окислитель на нашей планете. Кстати, именно благодаря атомарному кислороду озон проявляет свои бактерицидные свойства. Так что, в некотором роде, озон и гипохлорит натрия — «кислородные братья» :)
Отбеливающая способность гипохлорита натрия (и подобных ему химикатов) обусловлена их способностью разрушать светопоглощающие структуры (т.н. хромофоры) в органических молекулах. Притом это могут быть не только хромофоры на тканях. Гипохлорит неплохо отбеливает пятна плесени на плитке, зубные пятна, вызванные флюорозом и удаляет пятна от танинов чая на кружках (т.н. «чайный камень»).
Хромофоры часто связаны с сопряженными системами, которые представляют собой структуры с чередующимися одинарными и двойными связями. Электроны в сопряженных системах делокализованы и способны существовать на разных молекулярных орбиталях. Электрон в определенном орбитальном состоянии может поглощать энергию и подниматься до более высокого энергетического состояния. Электронные переходы, возникающие в результате поглощения определенных длин волн, создают цвет, который является визуальным дополнением к длине волны поглощенного света. Атомарный кислород гипохлорита натрия либо разрушает сам хромофор, либо разрушает двойные связи в нем и изменяет краситель так, что он больше не может поглощать видимый свет «окрашивающей» длины волны.
Справедливости ради, стоит отметить, что хлорноватистая кислота образует соли не только с натрием, но и, например, с кальцием. Примером может служить та самая хлорная известь, широко используемая из-за своей дешевизны для дезинфекции складских помещений, животноводческих ферм, туалетов и т.д и т.п. На долю гипохлорита натрия приходится около 83% мирового потребления (в роли отбеливателя/дезинфектанта), на хлорную известь — остается 17%. В 2005 году в мире было использовано около 1 миллиона тонн гипохлорита натрия, причем около 53% этого количества использовалось в домашних хозяйствах для дезинфекции и отбеливания белья (+ мытья, т.к. щелочная среда раствора гипохлорита неплохо омыляет жиры и делает их водорастворимыми). Оставшиеся 47% приходились на очистку сточных вод и подготовку питьевой воды (а также очистку бассейнов и градирен ГЭС от биообрастания/водорослей/моллюсков, отбеливание целлюлозы/бумаги/тканей, и использование в роли реактива для химических синтезов). Водоочистной эффект, кстати, это не только дезинфекция. Это и удаление запахов (NaOCl нейтрализует сероводород и аммиак) и даже обезвреживание цианидов в сточных водах (например, после золотодобычи или гальванических ванн).
Хлорочка, как дезинфектант
Любое несчастье как индикатор проявляет самые лучшие и самые худшие черты человека. Так и с пандемией коронавируса. Для меня удивительно, что многие трезвомыслящие, прекрасные специалисты, поддавшись панике начали терять голову и выдавать что-то вроде «гипохлорит не убъет коронавирус» (или еще лучше «коронавирус — это ГМО бактерия»). Меня мало волнует мнение многочисленных youtube-блогеров и диванных аналитиков и т.п. с их дилетантскими «рассуждениями о рыбалке» (в канале LAB-66 уже приходится у особо рьяных кликуш и «одержимых мировым заговором» даже требовать диплом о наличии профильного образования). А вот к информации от WHO, CDC, EPA я стараюсь четко прислушиваться. Ожидаемо, что в мартовском бюллетене выпущенном одной из упомянутых организаций (EPA’s Registered Antimicrobial Products for Use Against Novel Coronavirus SARS-CoV-2, the Cause of COVID-19) в списке эффективных «коронавирусных» дезсредств оказалось достаточно много гипохлорита. Удивляться здесь нечему, ведь NaOCl — это одно из оптимальнейших дезсредств (из-за комбинации широкого спектра активности, доступности и отсуствия долгосрочного вредя для окружающей среды). По поводу дезинфицирующего эффекта смотрим картинку (кликабельна):
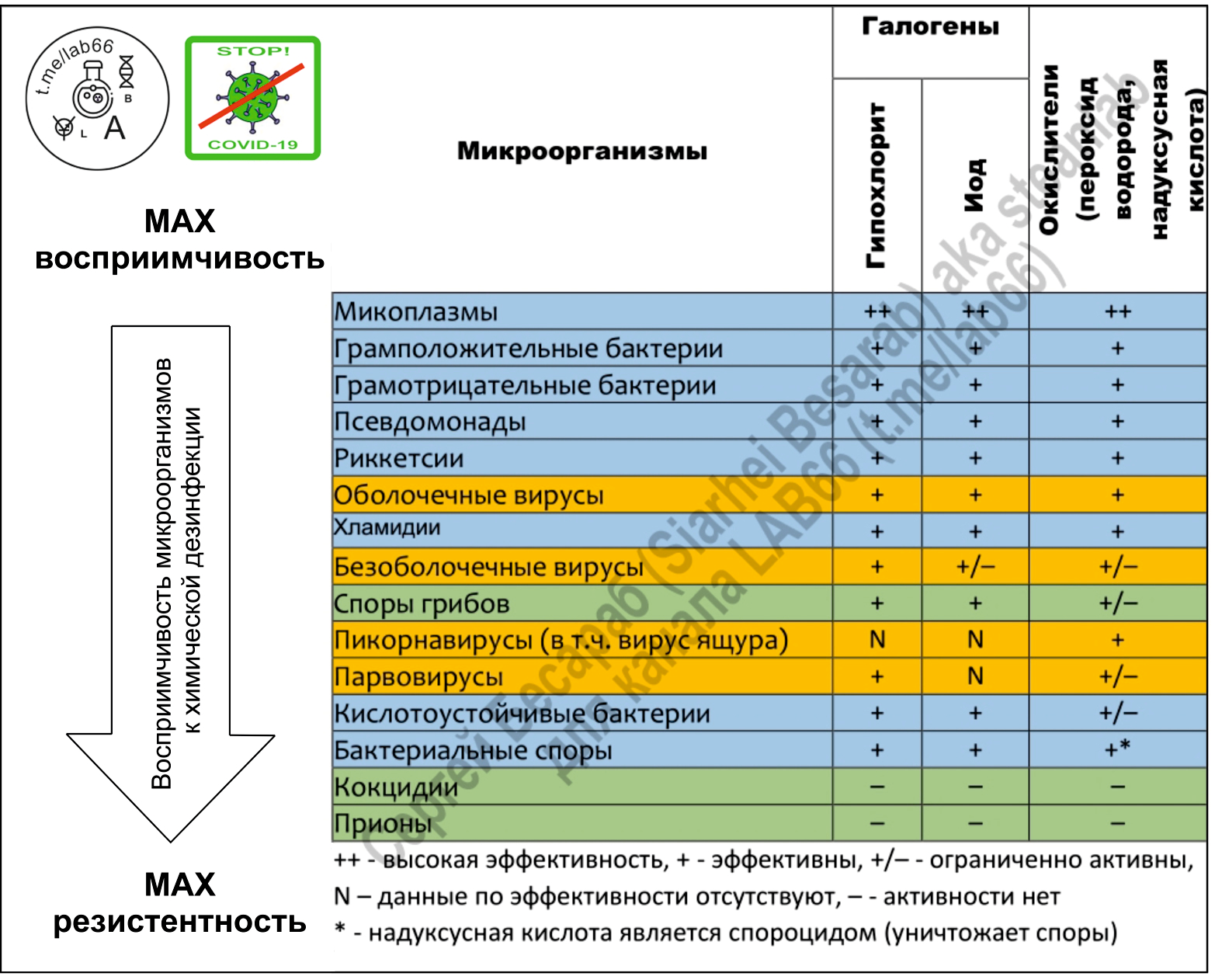
На всякий случай напоминаю, COVID-19 — это оболочечный вирус, который содержит внутри своего «конвертика» одноцепочную РНК.
В принципе, любые дезинфицирующие средства на основе хлора, так или иначе действуют через образование HOCl (та самая хлорноватистая кислота). Но сильный бактерицидный эффект гипохлорита связан не только со способностью продуцировать атомарный кислород, но и с действием гидроксильных ионов. Щелочная среда нарушает целостность цитоплазматической мембраны и приводит к необратимому ферментативному ингибированию, изменению клеточного метаболизма и деградации фосфолипидов (как при гипероксидировании липидов). Гипохлорит натрия воздействует на ферментативный аппарат бактерий, способствуя необратимой инактивации, вызванной щелочной средой и хлораминированию вызванному хлором. Т.е. можно сказать, что при обработке гипохлоритом зараженного объекта одновременно происходят реакции омыления липидов, нейтрализации аминокислот и хлораминирования. Таким образом не только дезактивируются многие микроорганизмы, но и происходит деградация липидов и жирных кислот, с образованием ПАВ (=мыла) и глицерина, т.е. уже упомянутая реакция омыления. Гипохлорит не только дезинфицирует, но еще и моет :) Логично, что при таком действии выработать резистентность (как к антибиотикам) практически не реально.
При обработке живых тканей важна еще и такая вещь, как биосовместимость. Это способность химического реагента вообще не реагировать с биологическими тканями на протяжении какого-то периода времени (и иметь умеренную реакционную способность в течении недели, постепенно снижающуюся к 0). Высокие концентрации гипохлорита достаточно агрессивны (см. раздел про технику безопасности), но вот в концентрациях 0,5-1% это очень даже биосовместимый препарат. Поэтому гипохлорит натрия высоких концентраций используется для хлорирования воды на некоторых (!) станциях водоподготовки — 12% раствор — некоторых, потому что чаще всего используют хлор в баллонах. 15% раствор используют для обеззараживания сточных вод на очистных сооружениях. Растворы с концентрацией не менее 10% используются для очистки воды в бассейнах и удаления биопленок. Кстати, именно гипохлорит натрия может быть прекрасным средством для уничтожения возбудителей легионеллёза. Эти микроорганизмы, кстати, очень часто в тех самых биопленках и обитают.
Ну а в дезинфицирующих спреях и салфетках, используемых на твердых поверхностях, чаще всего используются концентрации до 1,5%. Кстати, про то, как сделать самодельные салфетки с гипохлоритом я достаточно давно писал на Patreon в своей статье "Реверс-инжиниринг влажной салфетки или Гипохлорита вам в ленту". Кстати, пользуясь случаем выражаю благодарность всем мои «патронам». Вас мало, но вы поддерживаете серьезно!

Традиционно считается, что для обработки больниц и помещений, загрязненных жидкостями организма (кровью и т.п.) необходимо использовать 0,5% раствор. Такой концентрации достаточно, чтобы дезактивировать клостридиум диффициле в фекалиях или уничтожить какие-нибудь папилломавирусы человека. Для обработки/мытья рук чаще всего используется 0,05% раствор гипохлорита, который готовят из гранул (на картинке — выдержка из инструкции по обеззараживанию в условиях эпидемии лихорадки Эбола):

На Западе также активно используется т.н. "раствор Дакина" (
Замечание 1. про другие «хлорные дезинфектанты».
Помимо упомянутых уже мной гипохлорита натрия и гипохлорита кальция, существуют и другие вещества, способные активно продуцировать хлор (ну а хлор с водой = «малостабильная хлорноватистая кислота HOCl» и далее опять см. п. «Хлорочка, как дезинфектант»). Притом там могут быть и вещества органической природы. На просторах интернета я нашел информацию (скорее всего выдранную из какой-то советской книги по гражданского обороне — потому что многие наименования, да и сами препараты давно перестали существовать). Эта таблица дает примерное представление о спектре препаратов и их сравнительной «дезмощности по хлору». Почистил авторски и предлагаю на ваш суд. Можно, по крайней мере, примерно прикинуть/сравнить активность разных дезсредств (если захочется что-то отличное от старого доброго NaOCl):
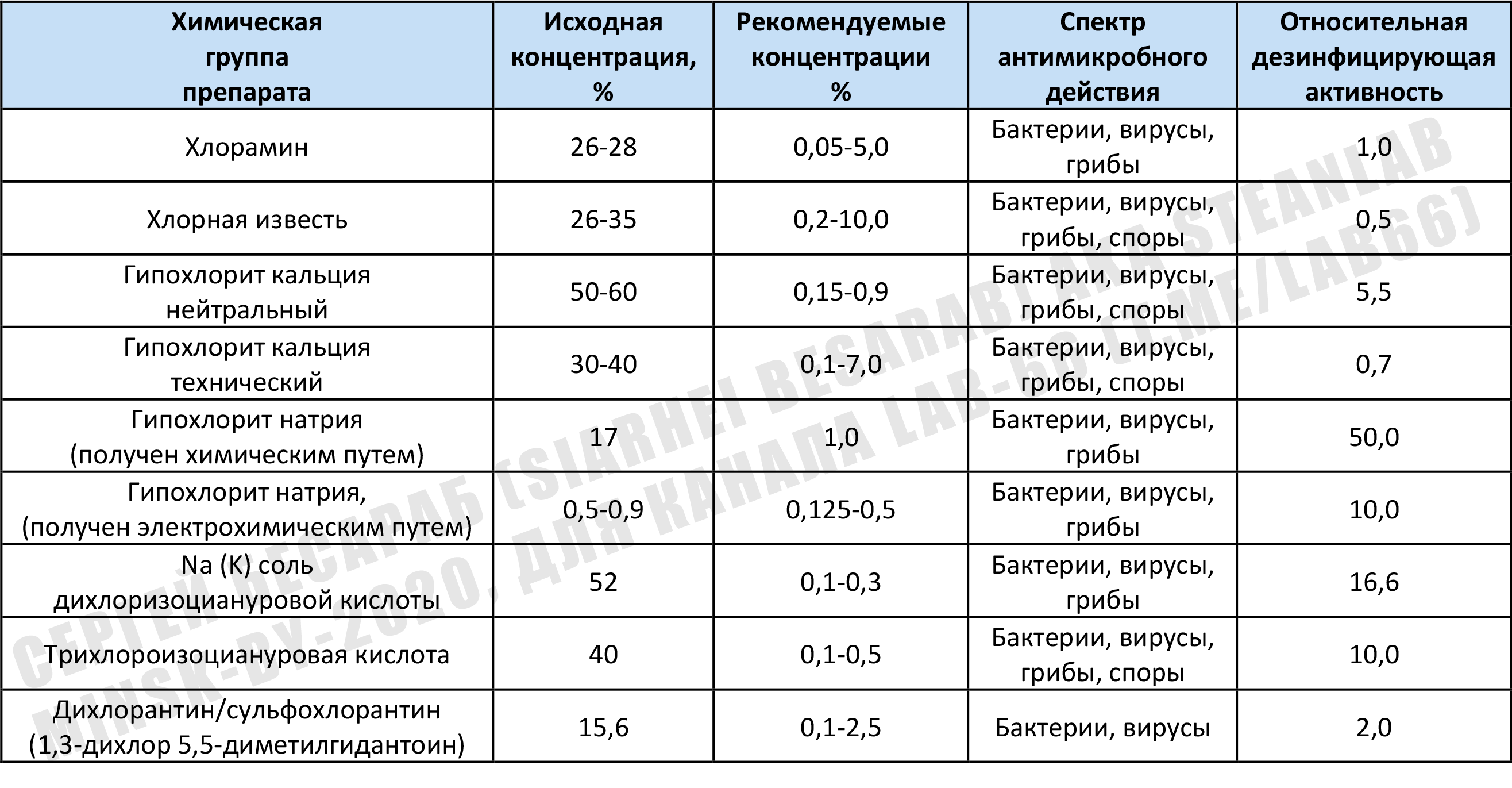
Возможно, читателю может встретится такой дезинфектант, как хлорцин (это НЕ украинская мазь с одноименным названием). Это Na-ДХЦК (натриевая соль дихлоризоциануровой кислоты — хлорцин Н) — 30,0% (или К-ДХЦК — 20,0% — хлорцин К), триполифосфат натрия — 6%, ПАВ (сульфонол) -3%, сульфат натрия — до 100%. Хлорцин содержит 11 — 15% активного хлора. Может встречатся и т.н. препарат ДП-2. Зашифрованного названия не стоит пугаться, по сути — обычная трихлороизоциануровая кислота с добавками ПАВ.
Замечание 2. «хлорка которая лечит»
Все яд и все лекарство. Не стали исключением и гипохлорит, который может не только уничтожать все живое, но и лечить, например, поражения кожи. Сразу хочтеся вспомнить ванны с разбавленным гипохлоритом, которые на Западе (
В «медразделе» не грешно упомянуть и про применение гипохлорита натрия в стоматологии (ибо именно стоматологи у меня чаще всего интересовались вопросами концентрации, разведения в и т.п.). Гипохлорит натрия является препаратом выбора в эндодонтии и очистке корневых каналов. Чаще всего стоматологами используются концентрации от 0,5% до 5,25% (стандартный — 2%). Здесь работает правило — низкие концентрации гипохлорита удаляют преимущественно некротические ткани и некоторые виды бактерий, высокие концентрации — повреждают живые ткани, но наиболее полно уничтожают микробы. Кстати, вместо повышения концентрации можно подогреть раствор (50-60 °C), что даст сравнимую с более концентрированным раствором эффективность в удалении мягких тканей и дезинфицировании корневого канала.
Замечание 3. Про очистку воды в полевых условиях.
Тема очистки воды достаточно обширна и вполне достойна отдельной статьи. Я же кратко упомяну про очистку воды в полевых условиях. Ведь бывают ситуации, когда ни то что озонатор или уф-лампу использовать, а даже и закипятить воду тяжело. Поэтому у химических обеззараживателей, на мой взгляд, пока особой альтернативы не видно. Хлорное обеззараживание может считаться старейшим вариантом полевой дезинфекции воды. Американские военные еще во время Второй мировой войны в составе сухпайка имели таблетки «Halazone», с натриевой солью 4-[(дихлорамино)сульфонил]бензойной кислоты.

Потом постепенно это вещество вытеснил дихлоризоцианурат натрия (тот самых ДХЦК), именно он был в составе широко известных в узких кругах таблеток «Пантоцид». Американский вариант — это ДХЦК спрессованый с адипиновой кислотой и содой, быстрорастворимые таблетки. Стоит отметить, что для полевой дезинфекции могут использоваться и таблетки для обеззараживания бассейнов (двухкомпонентные, содержащие смесь хлорит+хлорат+карбонат натрия и гидросульфат натрия), продуцирующие диоксид хлора. В целом, такой вариант подходит и для обеззараживания питьевой воды. Причем этот вариант, например, эффективен против лямблий больше чем обычный хлор. Все описанные варианты — удобны in situ (туристы, военные, МЧС и т.п.). Для вариантов вроде стихийного бедствия или какой-нибудь техногенной катастрофы таблетки могут быть недоступна, а то и слишком дороги. Для этой цели вполне можно использовать и Белизну (желательно без всяких ПАВ-ов и отдушек). Необходимо всего пару капель 5% гипохлорита натрия на литр воды с выдержкой в емкости с закрытой крышкой в течении 30-60 минут. Перед непосредственным употреблением желательно крышку открыть и «дать проветриться». Не стоит сразу лить в себя, как бы там не хотелось пить.
CDC в рамках своей стратегии «Безопасная система водоснабжения» (SWS) для развивающихся стран рекомендует для обеззараживания воды использовать 0,5–1,5% раствор гипохлорита натрия. EPA, кстати, советует использовать 8,25% раствор гипохлорита натрия (две капли на литр и экспозиция 30 минут), важное замечание "удвойте количество отбеливателя, если вода мутная, окрашенная или очень холодная. после обработки вода должна иметь слабый запах хлора. Если нет, повторите дозировку и дайте постоять еще 15 минут перед использованием". Стоит отметить, что на крайний случай, для дезинфекции воды можно использовать и гипохлорит кальция («хлорную известь»).
Замечание 4. «Хлорка» vs плесень, грибки и микотоксины.
А затем они повредили его нервную систему русским боевым микотоксином…
Уильям Гибсон «Нейромант»
Существует в немногочисленном мире «химиков, которые в теме» такой «Грааль» как микотоксины. Обыватель чаще всего ничего про это не слышал, или слышал краем уха (типа «Джонни Мнемоника отравили таким веществом...»). По сути ж, это тема отдельной и очень интересной статьи. Пока же просто скажу, что микотоксины в простейшем применении = плесень, плесневые грибы различных разновидностей, которые могут встречаться на овощах, фруктах, крупах и т.д. и т.п. Микотоксины — невозможно смыть водой или мылом, невозможно удалить срезав подгнившую кожицу. Микотоксины — могут равномерно распределятся по всему объему картошки/яблока и т.д. и т.п. И, к сожалению, многие микотоксины в человеческом организме вызывают множественные симптомы поражения органов (при попадании на кожу, в лёгкие или в желудок). Из-за того, что концентрации их достаточно малы (сомневаюсь, что кто-то постоянно есть гнилые фрукты или плесневелые орехи) — воздействие это растянуто по времени и кажется чем-то привычным (= «заболел от генетической предрасположенности/пьянства/плохого воздуха», а не потому что отравлен микотоксинами из некачественных круп). Про это можно говорить долго, но герой моей статьи гипохлорит, а значит надо бы свести тему к нему.
А сводится все к тому, что гипохлорит натрия в определенных концентрациях может использоваться не только для уничтожения микробов и плесневых грибов (см. таблицу в начале раздела "Хлорочка, как дезинфектант"), но и для дезактивации того, что после них осталось, в т.ч. плесневых, растительных токсинов и токсинов животного происхождения.. Более подробно — смотрите таблицу (30-минутная экспозиция). Плюсик — токсин дезактивируется, минус — нет.
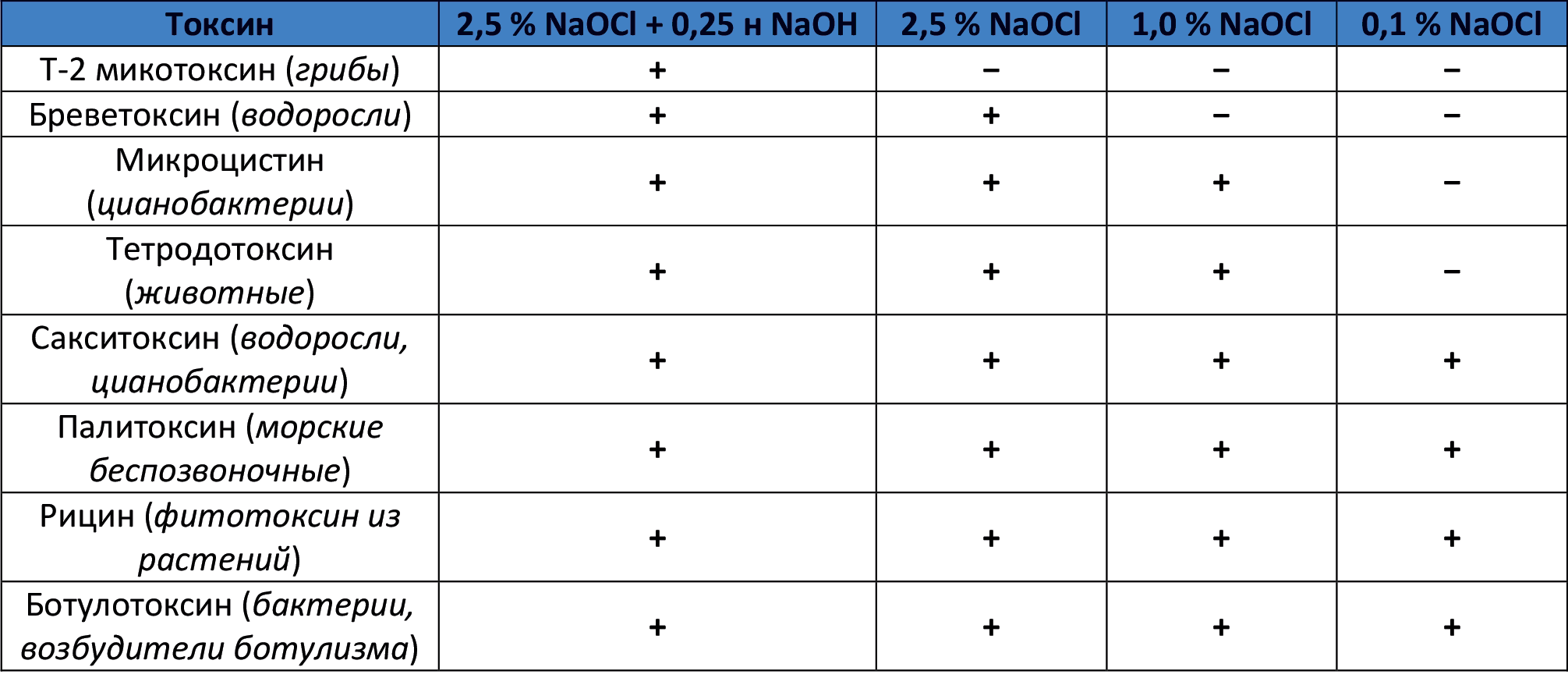
Так что, глянув на таблицу, можно увидеть, что гипохлорит натрия способен дезактивировать Т-2 микотоксин, который выделяется плесневыми грибами рода Fusarium.
T-2 токсин — трихотеценовый микотоксин, чрезвычайно токсичен для эукариотических организмов. Вследствие употребления заплесневевшего зерна или муки возникают отравления человека или сельскохозяйственных животных. Острые токсические симптомы включают рвоту, диарею, раздражение кожи, зуд, сыпь, волдыри, кровотечение и одышку. Если человек подвергается воздействию Т-2 в течение более длительного периода, наблюдается постепенная дегенерация костного мозга и развивается пищевая токсическая алейкия (АТА).
И уже привычно не отмахнешся, не успокоишь себя фразой «да где тот микотоксин и Fusarium, а где я» и водочкой, привычно, не полечишь… Потому что они — много где. На клубничке например:


Так что, вполне себе вариант снижения количества микотоксинов в подозрительных фруктах и овощах — это купание их в щелочном гипохлорите натрия с последующим обычным мытьем. При таком варианте обработки убиваются практически все возможные «поверхностные зайцы».
Стабильность и сроки хранения (=есть ли смысл закупать впрок?)
Если химия и медицина для рядового технаря не особо интересны (достаточно знать работает или нет), то вопросы стабильности при хранении — наоборот, первостепенны. Ведь гипохлорит натрия — вещество малостабильное. При комнатной температуре распадается примерно 0,75 г активного хлора в сутки, т.е. раствор с содержанием 250 г/л гипохлорита натрия теряет примерно половину активного хлора за 5 мес, с содержанием 100 г/л - за 7 мес, 50 г/л - за 2 года, а 25 г/л - за 5–6 лет.
Его устойчивость зависит от ряда факторов:
• Концентрация гипохлорита
• Температура
• Щелочность и значение pH
• Концентрация примесей, которые катализируют разложение и/или образование хлоратов
• Воздействие света
В большинстве случаев распад протекает по таким вот основным механизмам:
2NaOCl → 2NaCl + O2 (A)
3NaOCl → 2NaCl + NaClO3 (B)
Пройдусь по каждому пункту отдельно:
Концентрация: чем более концентрированный раствор, тем быстрее он разлагается, соответственно самые слабые растворы — самые стабильные. Литературные данные указывают на то, что при снижении концентрации гипохлорита натрия в два раза, скорость разложения уменьшается в 5 раз. Это связано с уменьшением общей концентрации ионов и со снижением ионной силы раствора. Разбавление снижает как концентрацию NaOCl, так и концентрацию других ионов (равновесных хлоридов, хлоратов, гидроксидов и т.д. — см. картинку «равновесия рН» ниже).
Температура: распад гипохлорита в повышением температуры в 90% случаев проходит по уравнению (B). Можно держать в уме следующее правило — скорость разложения возрастает в 3–4 раза, для каждых 10 °C для растворов с концентрациями гипохлорита натрия от 5 до 16%. А если напрячься и снизить температуру хранения хлорки до 5 °C (при условии полного отсутствия примесей металлов и других факторов ускоряющих разложение), то хранить в темной бутылке можно будет практически вечно.
Щелочность и рН раствора: для стабильного хранения раствор гипохлорита должен иметь pH от 11,5 до 12,5. В случае разбавленных растворов NaOCl при pH ниже 10,8 скорость разложения начинает значительно увеличиваться, достигая максимального значения в диапазоне 5-9. Но здесь есть нюанс. Когда рН раствора уменьшается, содержание HOCl увеличивается и растет окислительно-восстановительный потенциал (см. картинку с изменением форм активного хлора в растворе гипохлорита натрия в зависимости от рН раствора, Сl2 — молекулярный хлор, ClO–-гипохлорит-ион, HClO-хлорноватистая кислота).

Т.е. для хранения оптимальнее высокощелочные растворы, а для экстренной дезинфекции — растворы с низким рН. Хотя, говоря начистоту, повышать рН тоже необходимо до разумного предела. Если pH превышает значение 13 — скорость разложения опять скачкообразно увеличивается. Это происходит из-за увеличения ионной силы раствора, вызванного присутствием сильного избытка щелочи (NaOH). В целом можно использовать за правило — для хлор-содержищих дезсредства используем только щелочную среды. Для пероксидных дезсредства — наиболее эффективна кислая среда. ЧАС-ы несовместимы с кислотами и резко теряют в их присутствии свои дезинфицирующие свойства. Альдегиды (вроде формалина и глутаральдегида — работают и в кислой, и в щелочной среде)
Примеси: алюминий, медь, никель, железо, кобальт, марганец и т.д. являются катализаторами разложения NaOCl. Металлы в основном катализируют разложение по реакции (A) с образованием газообразного кислорода. Твердые суспензии, такие как, например, частицы графита в гипохлорите натрия, получаемом электрохимическим методом, также вызывают разложение NaOCl, в частности, по реакции (B) с образованием хлората натрия. Кстати, как говорят некоторые производители дезсредств, добавки сульфата магния, силиката натрия, борной кислоты - замедляют распад.
Воздействие света: воздействие света ускоряет процесс разложения NaOCl в растворе. Современные методы упаковки и использование непрозрачных полиэтиленовых бутылок практически исключают влияние света на стабильность растворов. Янтарные или зеленые стеклянные бутылки также имеют такой же результат.
Подводя итог, можно сказать следующее. Самым долгоиграющим будет препарат, который:
• Имеет низкую концентрацию гипохлорита
• <11,5 рН в диапазоне > 13
• В котором отсутствуют примеси металлов/графита (=отфильтрованный)
• Хранится при температуре <30°С (=в холодильнике)
• Упакован в абсолютно непроницаемые для света контейнеры
Совместимость материалов
Вопрос совместимости материалов перекликается со сказанным ранее (особенно, относительно металлов). На представленной ниже таблице можно даже увидеть с какой скоростью что корродирует.
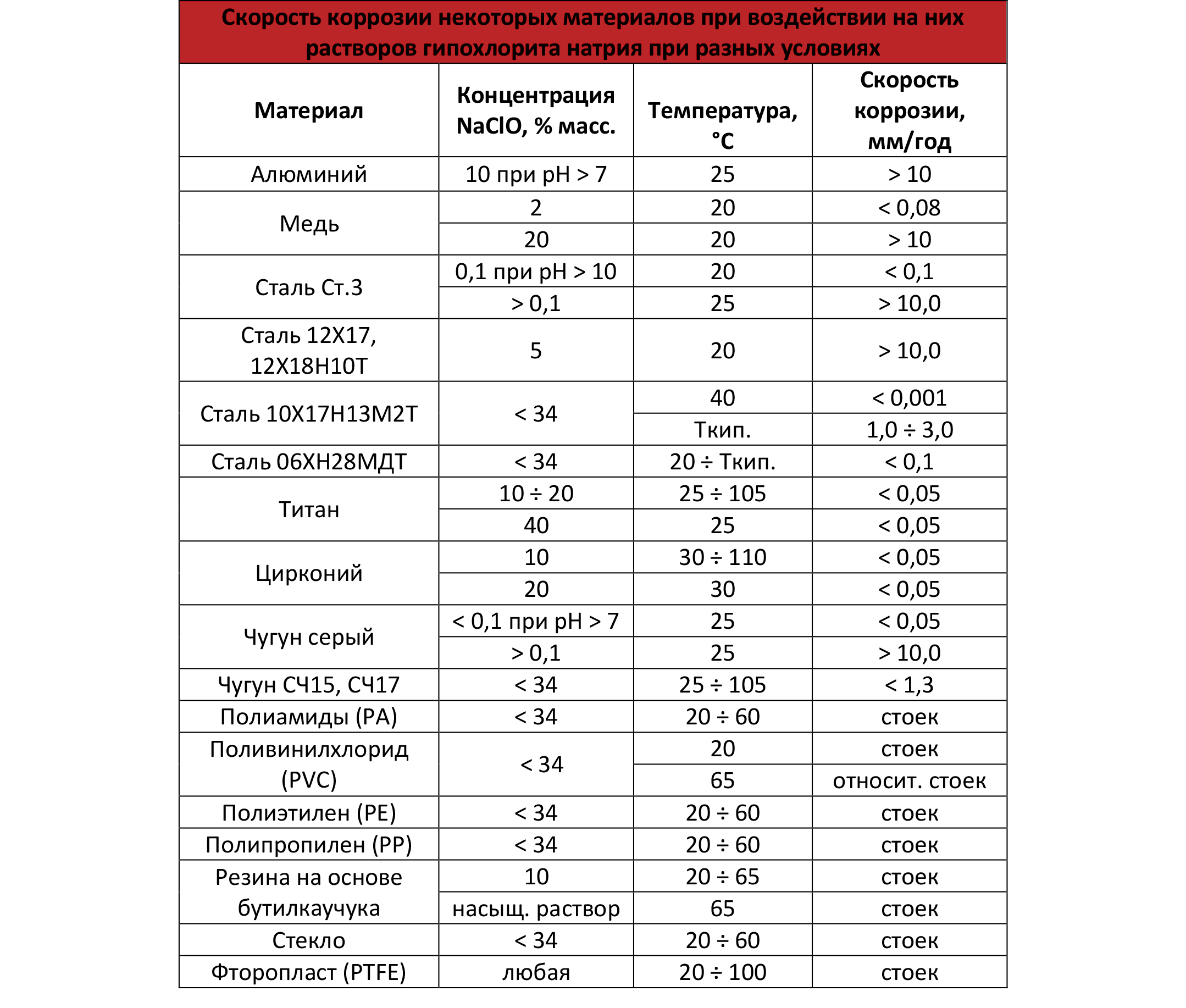
Здесь же и видно, что вопрос совместимости материалов актуален в основном для случая хранения/перевозки гипохлорита высоких концентраций и рядового «дезинфектора» волновать должен слабо. В общую копилку упомяну еще несколько материалов, которые рекомендуются на роль прокладок/конструкционных материалов при работе с концентрированным гипохлоритом натрия:
• PVDF (фторированный поливинилиден)
• Этиленпропиленовый каучук
• Хлорбутилкаучук
• CPVC (хлорированный поливинилхлорид)
• Тантал
• FRP (стеклопластик с подходящей инертной смолой и системой отверждения)
• Полидициклопентадиен

Техника безопасности при работе с гипохлоритом
В целом, типичный (=разбавленный) бытовой отбеливатель вроде белизны не опаснее воды (если с ним уважительно обращаться, бутылочку там подписывать, от детей прятать и т.п.). По статистике, в 2002 году в Великобритании было зафиксировано около 3300 несчастных случаев, связанных с гипохлоритом натрия. И абсолютное большинство из них — употребление дезинфектанта внутрь… Думаю, комментарии излишни.
Что касается гипохлорита натрия «промышленной концентрации», т.е. такого которым очищают сточные воды, то он уже относится к суровому первому классу опасности (класс 1B-поражение кожи + класс 1-поражение глаз).
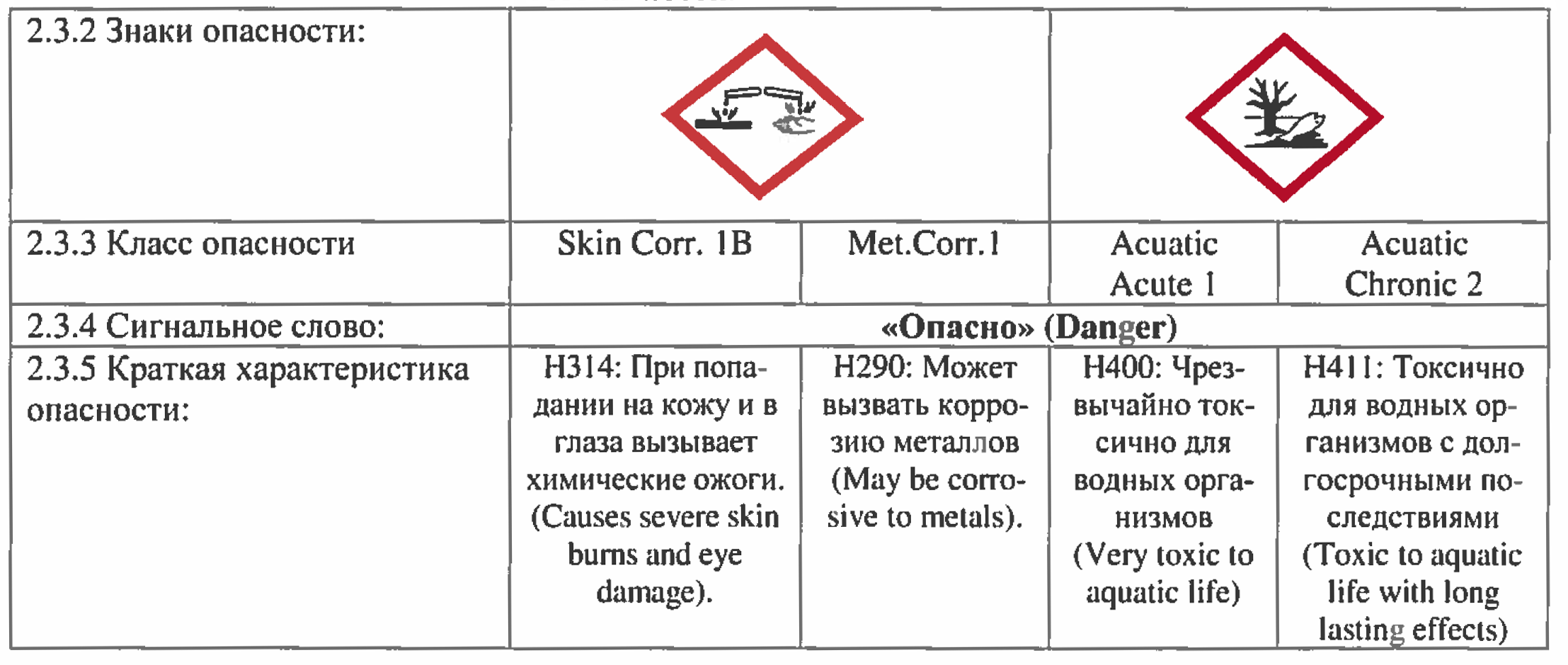
Если расшифровать — при попадании на кожу и в глаза вызывает химические ожоги. Будет вызывать раздражение и при попадании на слизистые оболочки верхних дыхательных путей (при вдыхании). Отдельного упоминания заслуживает и такой камень преткновения, как «хлорка в воде бассейна». Как правило, концентрация гипохлорита натрия, присутствующая в плавательных бассейнах абсолютно не вредна для людей. Но! Но дело меняется, если в воде присутствует большое количество мочевины (смесь мочи и пота), и тут уж хлорноватистая кислота и мочевина вступают в реакцию с образованием ядреных хлораминов (о механизме образования — ниже). Именно хлорамины раздражают слизистые оболочки и дают т.н. «запах хлора». В нормальных бассейнах этого быть не должно (нормальный = тот, в котором меняют воду и работает вентиляция). Если же этого не происходит, то постоянное воздействие летучих хлораминов может даже привести к развитию атопической астмы (см. статью).
Лечение при отравлении:
Учитывая все выше сказанное, решил я прикрепить и небольшую «памятку для врача», чтобы случись что — все было под рукой. Описание действий на случай отравления гипохлоритом натрия. Оно, кстати, примерно такое же, как и в случае отравления щелочью (cкользкое ощущение отбеливателя на коже связано с омылением кожных масел и разрушением тканей). НО! Но это только для чистого гипохлорита натрия. В случае его комбинация с различными бытовыми химикатами — лечить возможно придется от отравления продуктами реакции (см. следующий пункт).

Замечание про «запах хлора»: часто можно услышать от читателей вопрос «чем убрать этот неприятный запах хлора с рук/полумаски/предметов». В таком случае поможет тиосульфат натрия, притом для активного удаления запаха хватит и раствора с концентрацией около 5 мг/л (0,005%). Промываем этим раствором руки или __ (вписать нужное), а затем промываем водой с мылом. Если же тиосульфата найти не удалось, то остается только проверенный способ — «выветривание запаха со временем».
Кстати, для нейтрализации разливов концентрированного гипохлорита натрия (будем считать что 5% и выше) можно также использоваться сульфит натрия, он работает по реакции:
NaOCl + Na2SO3 → NaCl + Na2SO4
или бисульфит натрия, который работает по реакции:
NaOCl + NaHSO3 + NaOH → NaCl + Na2SO4 + H2O
А можно, в случае очень небольшого количества гипохлорита, использовать и перекись водорода, но с осторожностью (!) ибо там выделяется кислород.
Опасное соседство — НЕсовместимая бытовая химия
Гипохлорит натрия, являясь очень активным компонентом, легко вступает в химические реакции (в т.ч. и в фотохимические — т.е. с солнечным светом и ультрафиолетом от популярных ныне бактерицидных ламп). Часто в результате этих реакций выделяется хлор (=серьезный раздражающий агент), например при контакте нашей белизны и средства для очистки от ржавчины. При контакте гипохлорита с соединениями аммиака (в т.ч. с любимыми народом ЧАС-ы, которые сейчас начали добавлять в средства для мытья полов), и даже при контакте с мочой (!) в которой содержится мочевина — могут образовываться токсичные в обычных условиях хлорамины:
NH3 + NaOCl → NaOH + NH2Cl
NH2Cl + NaOCl → NaOH + NHCl2
NHCl2+ NaOCl → NaOH + NCl3
При контакте белизны с некоторыми бытовыми моющими средствами, содержащими ПАВы и различные отдушки могут образовываться летучие (!) хлорорганические соединения, вроде четыреххлористого углерода (CCl4) и хлороформа (CHCl3). Классы их опасности каждый может посмотреть сам. Например в статье исследователи показали, что при работе с некоторыми «хитрыми» средствами бытовой химии концентрации этих растворителей повышаются в 8–52 раза для хлороформа и в 1–1170 раз для четыреххлористого углерода выше допустимых соответственно. Самый низкий «выхлоп» летучей хлорорганики дает самый простой отбеливатель (читай «белизна»), а вот самый высокий — средства в форме «густой жидкости и геля» (типа всяких там Доместосов и иже с ними, которые и развести толком нельзя). Поэтому, на будущее, а) стоит всячески избегать «суперэффективных средств с новой формулой» (= дерьма, которое разработал менеджер, а не инженер) и придерживаться классической формулы «лучшая белизна = гипохлорит да вода». И б) использовать при уборке квартиры респираторы с угольным фильтром (=«для задерживания паров растворителей»).
С перекисью водорода гипохлорит натрия реагирует достаточно бурно, с образованием хлорида натрия (ваша любимая поваренная соль) и кислорода:
H2O2 + NaOCl → NaCl (водный) + H2O + O2
Гетерогенные реакции гипохлорита с металлами протекают достаточно медленно и дают в результате оксид металла (ну или гидроксид). На примере цинка:
NaOCl + Zn → ZnO + NaCl
С различными комплексами металлов белизна реагирует не в пример быстрее.
Как уже упоминалось, гипохлорит натрия не любит высокую температуру (выше 30°C), и при нагревании распадается на хлорат натрия и кислород (для 5% раствора температура разложения ~40°C), если удастся нагреть до 70°С разложение может протекать со взрывом.
В целом, гипохлорит высоких концентраций негорюч и взрывобезопасен. Но при контакте с органическими горючими веществами (опилки, ветошь и др.) в процессе высыхания может вызывать возгорание. Вообще, такая реакционная способность — это одновременно и благо, т.к. вещество не может долго находится в неизменном состоянии в окружающей среде и быстро дезактивируется (=можно просто смыть в сточные воды).
В качестве выводов — все написанное выше сведено в единую таблицу несовместимых компонентов (кликабельна).
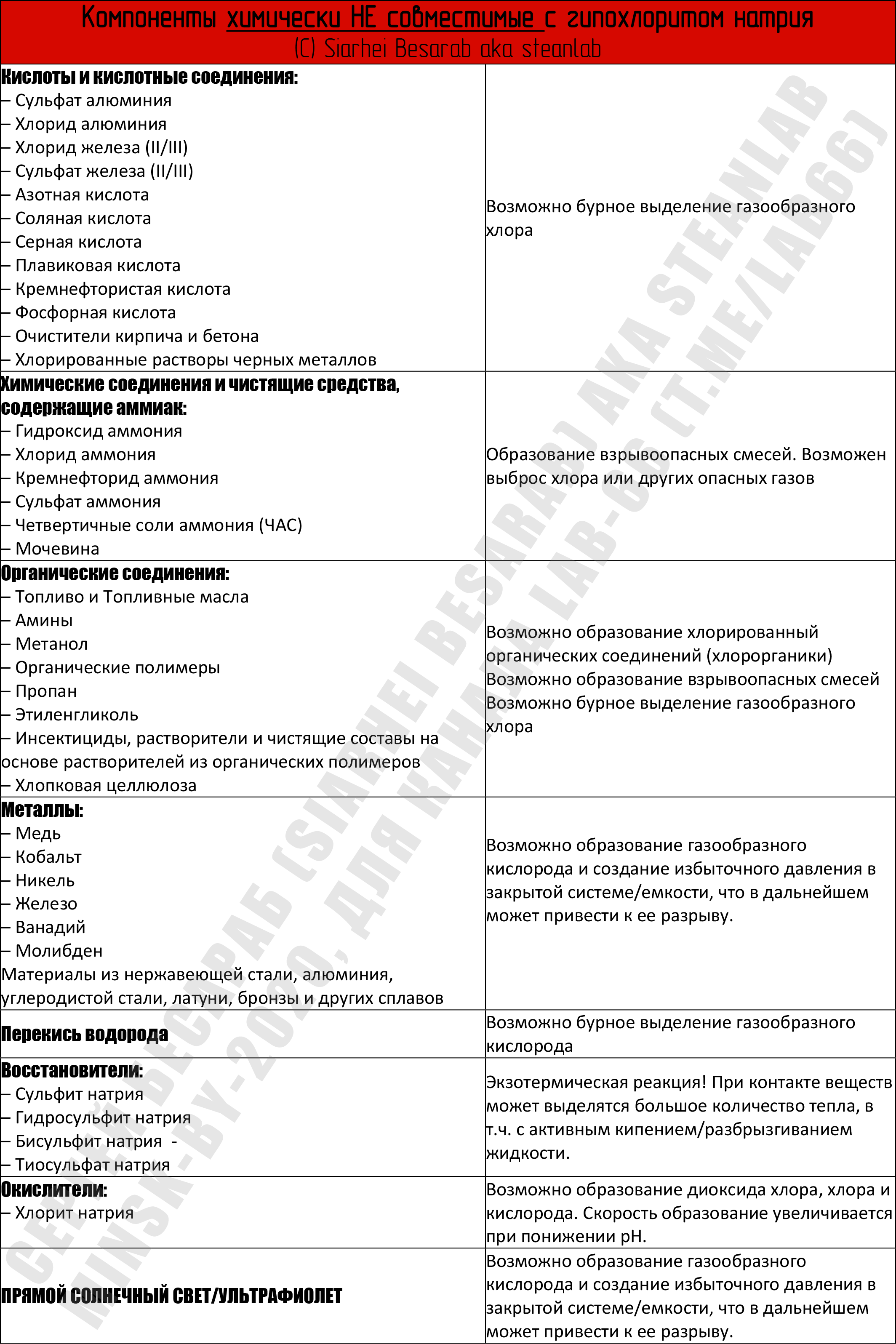
Некоторые из этих соединений можно найти в бытовых, автомобильных и промышленных химикалиях и смесях химикалий = средства для чистки окон, унитазов и поверхностей, обезжиривающие средства, антифризы, средства для очистки воды, химия для бань и бассейнов. Поэтому чаще смотрите не этикетку. Требуйте, чтобы на этикетке писали состав! Покупайте только то средство, где на этикетке есть максимальная информация о составе. Пора уже голосовать рублем за адекватное отношение к покупателю.
Практикум или Вся Белизна Минска
Полностью разобравшись с теорией, теперь мы подходим к самому интересному. К лабораторным занятиям. Как и обещал читателям, я проехался по Минску и собрал все доступные варианты жидкого отбеливателя (именно жидкого, на гели и т.п. я даже не смотрел). Теперь же я хочу рассказать как я их сравнивал и «проверял на вшивость» (= подходят ли они для целей дезинфекции).
Кстати, отмечу, что все описанные в статье методы вполне себе работоспособны в мирное время, для проверки качества воды в бассейнах или кранах. Если вдруг у кого-то возникнет желание сказать «вода плохая - воняет хлоркой» , то после прочтения статьи, надеюсь, это можно будет сделать без проблем. А нынче, нынче вода с хлоркой это благо во время пандемии…
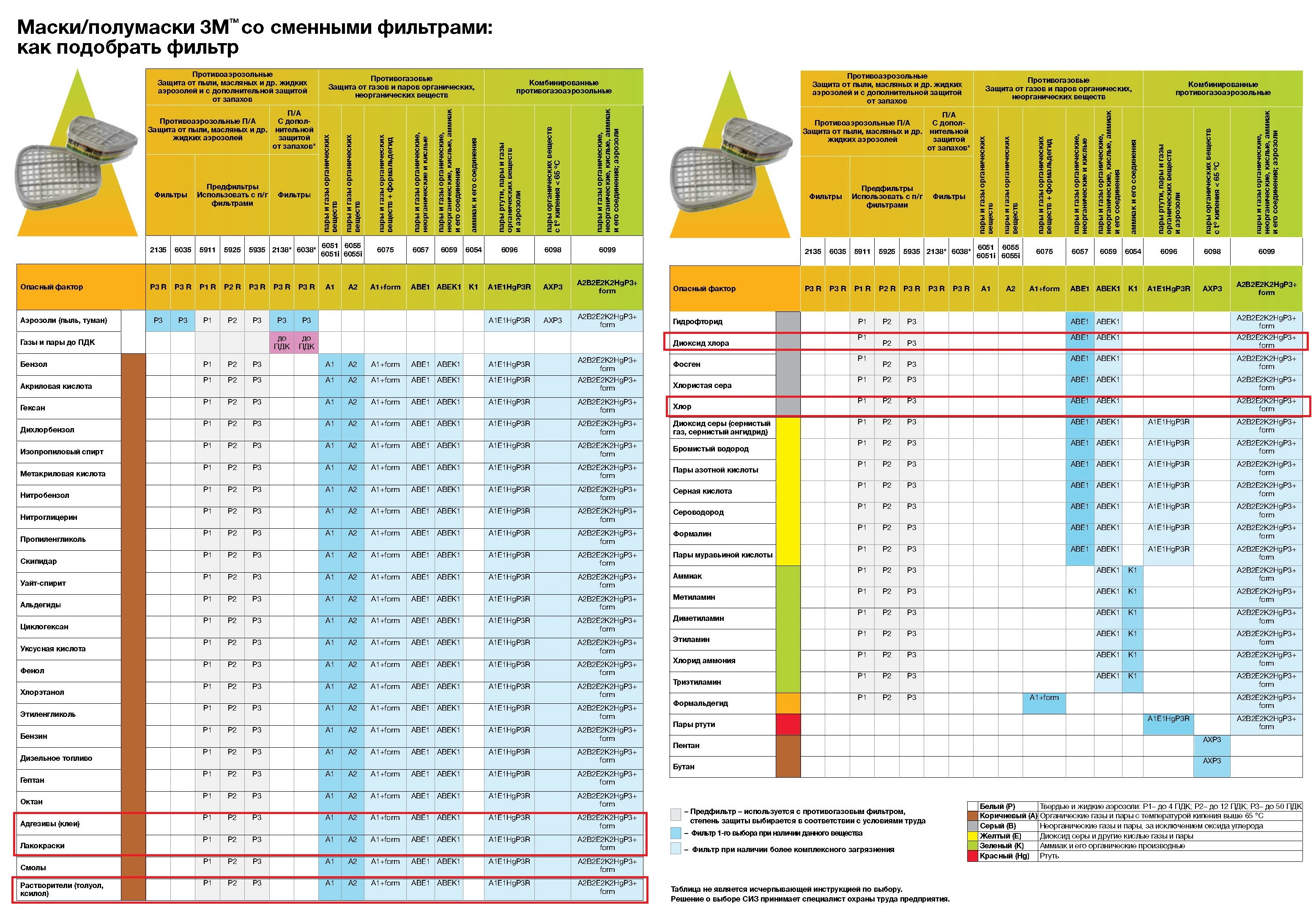
В общем, первым делом подбираем себе необходимые СИЗ (по желанию). Как я уже упоминал выше, для большинства задач (и прямых рук) достаточно перчаток. Не зная что в бутылках за смеси, я решил перестраховаться и использовать полный комплект защиты (только со своей полумаски 3М 7502 «коронавирусные» противоаэрозольники 6035 я заменил на угольные патроны класса «газы/пары» — типа ABE1, как в моем случае, или лучше ABEK1. Пойдут и отечественные противогазные коробки и респираторы для работы с парами растворителей.

С предварительными приготовлениями разобрались, и теперь я представляю вашему вниманию всю Белизну Минска! Встречайте беларуских красавиц! Это, кстати, все что удалось найти в гипермаркетах города-героя.

Первым делом я оценил внешний вид, т.е. цвет и консистенцию предлагаемых растворов (кликабельно). Хотя ожидать здесь чего-то экстраординарного не приходится (т.к. по условиям задачи — никаких гелей и прочего «химо-фарша», максимальная простота).

Потом измерил их плотность (кликабельно) + рН, он же водородный показатель.


А рН, рН — уж чем бог пошлет (вплоть до индикаторных бумажек, но учитывайте что краситель в бумажках будет моментально «выгорать» и обесцвечиваться). В моем же дорожном чемоданчике случайно завалялись рН-метры Hanna:

В результате получилась вот такая сводная таблица с данными (кое-что пришлось переписать с этикеток):
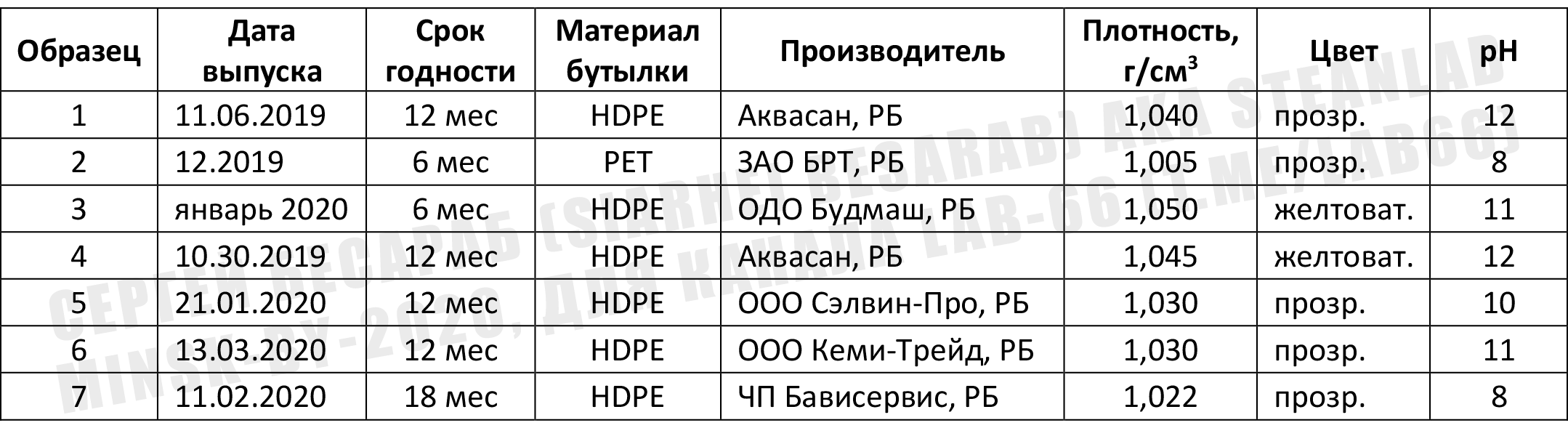
Отдельно напишу состав (т.е. то, что там есть еще КРОМЕ гипохлорита натрия, это важно, особенно учитывая всякие хлорамины и летучую хлорорганику, о которых я писал выше). Стиль написания сохранен, чтобы читатель понимал, кто пишет инструкции.
образец 1. Вода, анионный ПАВ – менее 5%, стабилизатор, комплексообразователь
образец 2. Вода
образец 3. Вода, НПАВ менее 5 (%), ароматизатор (свежесть) –менее 5%
образец 4. Вода, анионный ПАВ – менее 5%, стабилизатор, комплексообразователь
образец 5. Вода, щелочь – менее 5%, вода 30% и более
образец 6. <5% щелочь, вода, отдушка
образец 7. Более 30% вода питьевая, трилон Б, натрия гидроксид – менее 5%
Возможно «в рамках факультатива» я когда-нибудь сделаю анализ гелей с активным хлором. Но такая форма очень неудобна по нескольким причинам. Во-первых в составе могут быть взаимоисключающиее компоненты (см. таблицу несовместимости) и при открывании бутылки вы сразу начнете получать дозу хлора/хлорамина и т.п. Во-вторых из-за кучи добавок не совместимых с человеческим организмом — гели нельзя использовать для той же дезинфекции воды. Ну и в третьих, высокая вязкость раствора не позволит его ни развести нормально, ни использовать в комбинации с распылителем (например, для орошения ручек дверей).
Ну и наконец с подготовительным этапом закончили, теперь самое важное и интересное — концентрация гипохлорита натрия. Важна она потому что именно к этому показателю привязываются все рекомендации по дезинфекции. Ну а сами производители не идут навстречу покупателю и пишут черти что (cм. далее). Хотя узнать, сколько там гипохлорита не так уж и сложно. Поможет в этом такая методика, как титрование. Мы будем просто добавлять один компонент до тех пор, пока он полностью не прореагирует со вторым (сигнализировать об этом будет изменение цвета раствора). Для определения активного хлора в гипохлорите можно применить отечественную ГОСТ-овскую методику, а можно применить американскую АSTM.
NaClO + 2KI + 2H2SO4 → NaCl + I2 + K2SO4 + H2O
В американском методе используется уксусная кислота и реакция:
NaOCl + 2KI + 2CH3COOH → I2 + NaCl + 2KC2H3O2 + H2O
И в том, и в том методе выделившийся иод определяют титрованием тиосульфатом натрия.
В принципе, разницы по которой работать я лично не вижу, здесь играет роль доступность реагентов, я использовал ГОСТ-скую, т.к. серная кислота не так воняет как уксусная.

Метода ГОСТ Р 57568-2017 (упрощенная):
Для работы нам нужны следующие компоненты:
1)Серная кислота 1н.
Отмеряем 28,6 мл концентрированной серной кислоты (плотность = 1, 84 г/см3) и доводим до литра дистиллированной водой.
2)10 % раствор иодида калия
Взвешиваем 10 грамм иодида калия и растворяем в 90 мл дистиллированной воды. Раствор применяется свежеприготовленный
3)Раствор тиосульфата натрия 0.1н
Взвешиваем 25 г тиосульфата натрия (пентагидрата) и доводим дистиллированной водой до 1 л. Хранить в темной бутылке.
4)Раствор крахмала 1%
Взвешиваем 1 г крахмала (кукурузного, картофельного и т.п., хоть картошку натирайте и заваривайте, но! но не забудьте профильтровать :) ) и размешиваем с 10 мл дистиллированной воды. Затем кипятим в стакане 90 мл дистиллированной воды и когда закипела — вливаем наши 10 мл с крахмалом. Варим, перемешивая 2-3 минуты. Используем свежеприготовленным.
Сама процедура проверки следующая. Отбираем образец гипохлорита объемом 10 мл, и доводим водой до 250 мл. Отбираем из этого объема 10 мл и переносим в стакан, в этот же стакан добавляем 10 мл раствора иодида калия и 20 мл серной кислоты. Хорошо перемешиваем и ставим в темноту на 5 минут. По прошествии 5 минут капаем по каплям (из калиброванной капельницы, а еще лучше бюретки) раствор тиосульфата натрия пока раствор красного цвета (из-за выделившегося иода) не станет прозрачным.


Когда жидкость приобрете соломенный (светло-желтый) цвет — доливаем в стакан 2-3 мл крахмала, раствор синеет.

Теперь потихоньку добавляем тиосульфат пока синий цвет не исчезнет.
Какие могут быть нюансы, влияющие на результат определения? А вот следующие (советую их держать в уме):
• недостаточное количество иодида калия (= при приготовлении раствора вы использовали старый полуразложившийся реактив) добавленного к образцу приведет к тому, что прореагирует не весь гипохлорит и показатели активного хлора будут занижены. Поэтому лучше небольшой избыток иодида.
• плохое перемешивание иодида калия с гипохлоритом даст ту же ошибку, что и в предыдущем пункте. Поэтому очень хорошо перетрясите смесь растворов.
• готовить впрок раствор иодида калия нет смысла — его нужно использовать свежеприготовленным. При хранении в растворе иодид будет разрушаться, и в итоге давать заниженный показатель активного хлора.
• добавление кислоты до внесения раствора иодида приведет к потере определенной доли свободного хлора. Поэтому важно соблюдать упомянутый мной порядок: сначала иодид, потом кислота.
• титрование без добавления крахмала. Человеческий глаз слабо чувствителен к изменениям желтого цвета, что может привести к ошибкам и низкой точности полученных результатов.
• слишком раннее добавление крахмала приведет к необратимой реакции крахмала с йодом (образование красноватой окраски) и вам попросту не удастся отследить конец реакции. Добавляем крахмал когда цвет раствора соломенный (светло-желтый), а не красноватый.
• использование старого тиосульфата натрия. Этот реактив в растворе склонен к разложению (поэтому его нужно хранить в темной бутылке, вдали от солнечных лучей). Как вариант, либо каждый раз готовить свежий раствор, либо проверять существующий и вносить соответствующие поправки (первое — рекомендуется).
Во время нашего титрования подсчитываем количество капель, которое пошло на нейтрализацию гипохлорита и рассчитываем массовую концентрацию активного хлора по формуле:
Х=(Объем тиосульфата*0,003545*250*1000)/100.
Подготовка пробы: отбираем 25 мл исследуемого гипохлорита натрия, переносим в 250 мл колбу/стакан и взвешиваем на весах с точностью до 0,01 грамма. Затем доводим дистиллированной водой до метки в 250 мл. Хорошо перемешиваем. Затем отбираем из этой колбы/стакана 10 мл раствора и переносим в новую колбу/стакан на 250 мл. Добавляем туда 50 мл дистиллированной воды, мешаем, добавляем 25 мл 10% раствора иодида калия и опять мешаем. Раствор приобретает красно-коричневый цвет (см. картинку выше). Добавляем 10 мл нашего раствора уксусной кислоты. Опять мешаем 3-5 минут. Затем титруем, по каплям добавляя раствор 0,1 н. раствор тиосульфата натрия. Считаем объем тиосульфата, который на это идет. После того, как раствор приобретает соломенно-желтую окраску, добавляем 5 мл раствора крахмала и острожно, по капле добавляем в посиневший (см. картинку выше) раствор тиосульфат. Когда синий цвет исчез и раствор стал прозрачным — титрование закончено. Записываем потраченный объем тиосульфата натрия. Концентрация гипохлорита натрия рассчитывается по формуле:
% NaOCl = (Объем потраченного тиосульфата натрия*N*3,723722)/0,04*масса образца гипохлорита
N — нормальность раствора тиосульфата, у нас она 0,1
В результате титрования моих образцов получилось следующее (в скобках концентрация гипохлорита, которая считается по формуле: концентрация гипохлорита (NaOCl) = концентрация хлора*1,05:
образец 1. хлор 19.32 г/л = (NaOCl 20, 29 г/л) = 2,029 % раствор
образец 2. хлор 5.67 г/л = (NaOCl 5, 96 г/л) = 0,596 % раствор
образец 3. хлор 32.26 г/л = (NaOCl 33, 87 г/л) = 3,387 % раствор
образец 4. хлор 21.27 г/л = (NaOCl 22, 33 г/л) = 2,233 % раствор
образец 5. хлор 20.74 г/л = (NaOCl 21, 76 г/л) = 2,176 % раствор
образец 6. хлор 18.97 г/л = (NaOCl 19, 91 г/л) = 1,991 % раствор
образец 7. хлор 14.18 г/л = (NaOCl 14, 89 г/л) = 1,489 % раствор
Т.е. если считать что крайняя «короноубойная» концентрация гипохлорита натрия = 0,5%, то выходит что растворы нужно разбавлять в: 4 раза (средство 1, средство 6), 4,4 раза (средство 5) 4,5 раза (средство 4), в 7 раз нужно разбавлять средство 3. Средство 7 разбавляем в 3 раза, а средство 2 — вообще разбавлять не нужно (вот вам и прозрачная тара). Напоследок — фото с победителем:

Гомельский ОДО БУДМАШ! Хабра-привет вам и respect за вашу продукцию :).
На закуску покажу как полученные экспериментальные данные коррелируют с писаниной на этикетке:
образец 1. «гипохлорит натрия – 30% и более» = 2,029 %
образец 2. «гипохлорит натрия (5% или более, но не менее 15%) = 0,596 %
образец 3. «гипохлорит натрия 30 (%) и более» = 3,387 %
образец 4. «гипохлорит натрия – 30% и более» = 2,233 %
образец 5. «гипохлорит натрия – 5% и более, но менее 15%» = 2,176 %
образец 6. «<30% натрия гипохлориД» = 1,991 %
образец 7. «15% или более, но менее 30% натрия гипохлорит» = 1,489 %
Ответ — никак. Полный рандом. Так что здесь совет даже не «Доверяй, но проверяй!», а просто «Сразу проверяй, проверяй, проверяй!»
Что ж делать тем, кому титрование не по душе (хотя имхо — это самый просто и доступный даже в далекой деревне вариант, знай себе, только капли считай). Таким людям могут помочь специальные тест-полоски Дезиконт-ГН-01 (индикаторные полоски для экспресс-контроля концентраций рабочих растворов дезинфицирующего средства «Гипохлорит натрия»). Которые найти наверное гораздо сложнее, чем этанол в эпоху пандемии коронавируса :)
Можно попробовать прикинуть определить концентрацию и по температуре замерзания (чем она ниже — тем концентрированней гипохлорит).
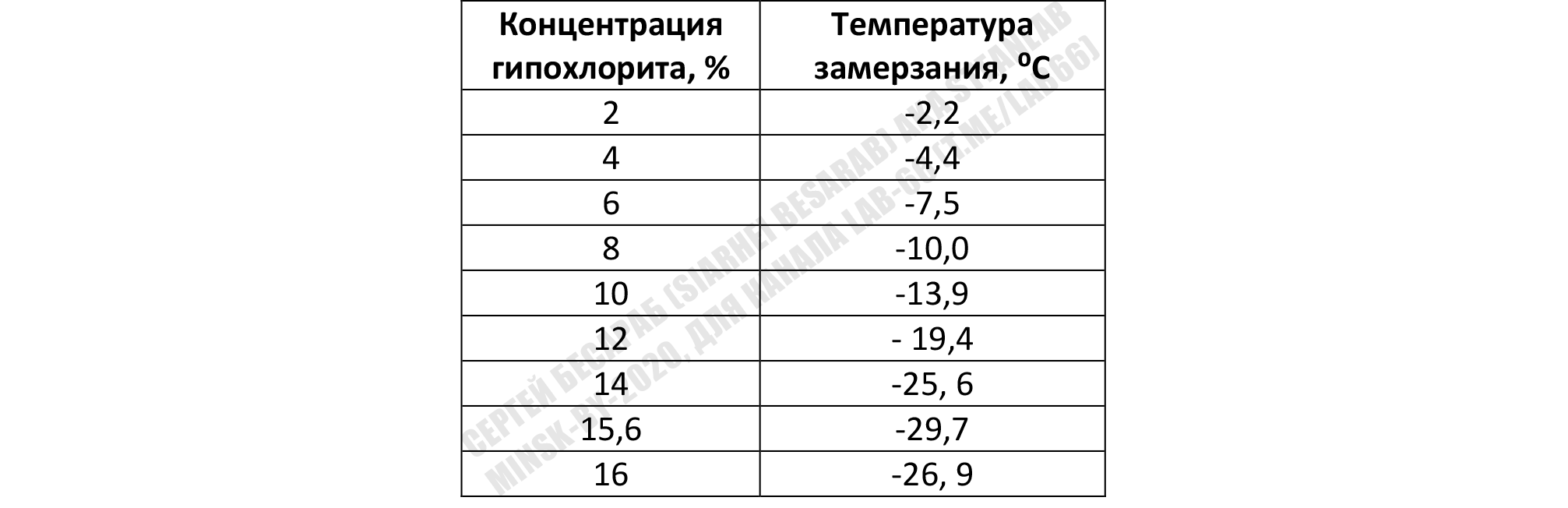
Можно измерить поверхностное натяжение, вязкость или проводимость раствора (TDS-метром с алиэкспресс, ага). Для 1% раствора NaOCl поверхностное натяжение = 75 дин/см, вязкость = 0,968 сантипуаз, проводимость = 65,5 миллисименс. Но корреляции на большую/меньшую концентрацию оооччееень условны и зависят от множества факторов.
Некоторым подспорьем, в случае отсутствия реагентов для титрования может оказаться сводная таблица корреляции плотности/избытка щелочи с концентрацией гипохлорита (правда только в случае, если концентрация >4%, что в наших краях возможно только если покупать промышленный гипохлорит используемый для нужд водоканалов, ибо белизна — сами видите, какая белизна):
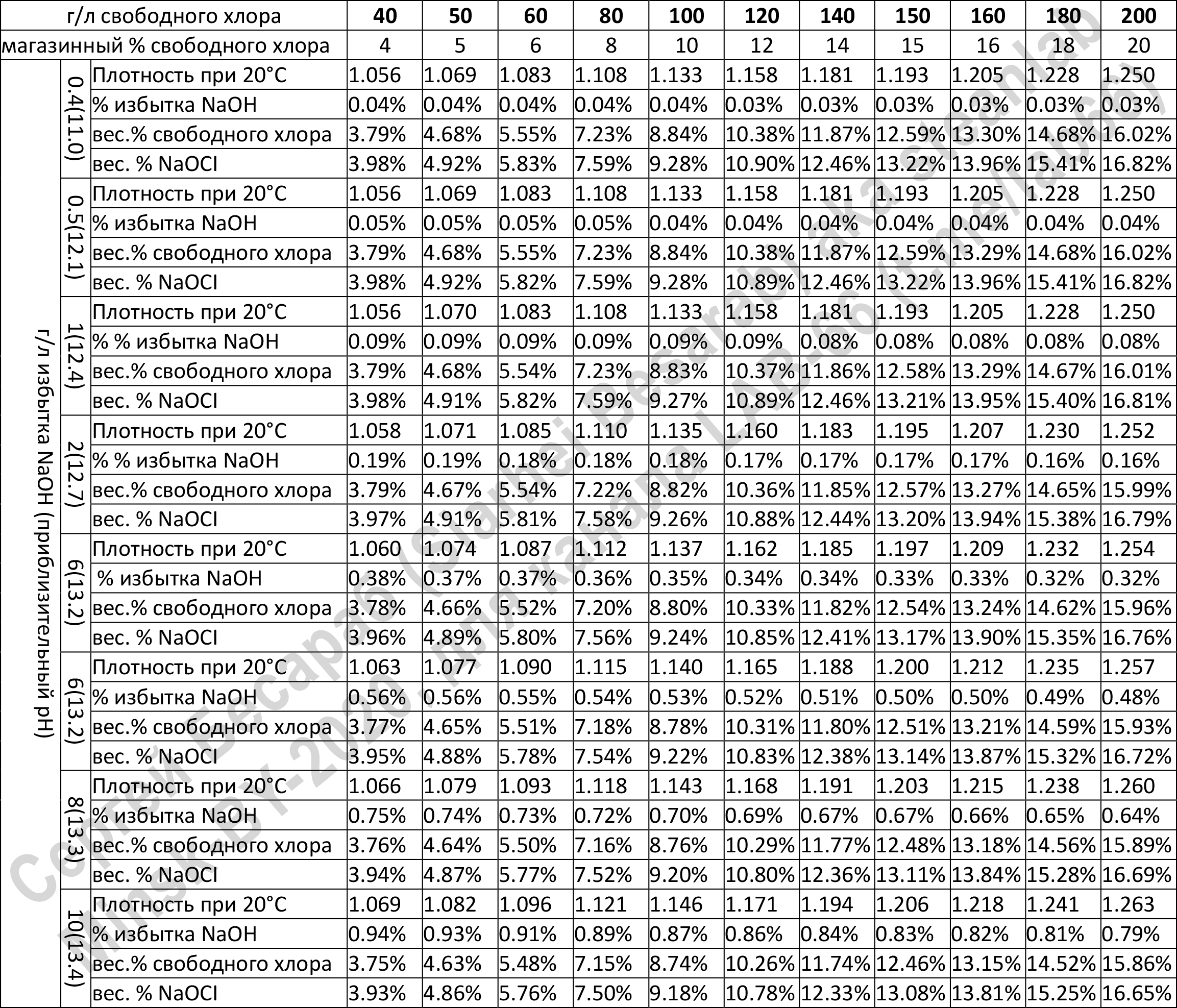
Кстати, допустим вы определились с необходимой для дезинфекции концентрацией, и с концентрацией купленной белизны, но… Но внезапно не знаете как развести ваше средство (фантастический, имхо, сценарий, но мало ли что, мы рождены ж чтоб сказку сделать былью). Для решения такой задачи вам понадобится пойти по ссылке "калькулятор разбавления растворов" и вписать туда нужные цифры. В качестве примера, возьмем нашего победителя, 1 литр белизны с концентрацией гипохлорита натрия 3,387 % от гомельского БудМаш и разведем до 0,5%, чтобы «помыть полы от коронавируса». Калькулятор нам пишет — нужно добавить 5,774 литра воды («растворителя»).

Как видите, ничего сложного. Обеззараживайтесь! :)
Краткие выводы:
• Гипохлорит натрия — это замечательный многофункциональный дезинфицирующий (и даже моющий) агент. Пригодится он может не только в случае коронавируса, но и при обеззараживании питьевой воды, для удаления плесени и грибков и даже чтобы для удаления чайного налета с кружек. Важно помнить, что гипохлорит натрия и хлорсодержащие соединения проявляют наибольшую активность только в щелочной среде
• При работе с гипохлоритом стоит использовать не только перчатки, но и угольные респираторы (особенно для новомодных гелей и т.п., выдающих потенциально канцерогенные пары)
• На этикетках продающихся в магазинах отбеливателей пишут лишь бы что (надеюсь, коронавирус это исправит). И в случае дефицита дезсредств — надеяться можно только на свою голову и инструкцию из статьи. Пока же, чемпион по содержанию NaOCl в Беларуси — Белизна гомельского завода Будмаш.
• Раздражаюший запах хлора с предметов (после протирания/орошения гипохлоритом) можно убрать а)проветриванием б)обработкой растворами тиосульфата натрия, сульфита натрия, бисульфита натрия или перекиси водорода.
Disclaimer: вся информация, изложенная в статье, предоставлена сугубо с информационными целями и не является прямым призывом к действию. Все манимпуляции с химическими реактивами и оборудованием вы проводите на свой страх и риск. Автор не несет никакой ответственности за небрежное обращение с агрессивными растворами, безграмотность, отсуствие базовых школьных знаний и т.п. Если не чувствуете в себе уверенности понять написанное — попросите проконтролировать ваши действия родственника/друга/знакомого который имеет хотя бы какое-то техническое образование (=«в школе неплохо учился»). Постарайтесь использовать СИЗ и максимально соблюдать технику безопасности. И да, обязательно убирайте домашних животных во время обработки! И если сами не моете свои руки 0,5% гипохлоритом натрия, то не делайте это и для лап своей собаки!
На этом все! Традиционно, предлагаю подписаться на мой научно-технический канал и подключаться к обсуждению!
• Jeffrey M. Levine Dakin’s Solution: Past, Present, and Future /Advances in Skin & Wound Care: The Journal for Prevention and Healing, 2013,volume 26, issue 9, pages 410–414
• D. N. Herndon, and M. C. Robson Bactericidal and Wound-Healing Properties of Sodium Hypochlorite Solutions: The 1991 Lindberg Award/Journal of Burn Care & Rehabilitation, 1991, volume 12, issue 5, pages 420–424.
• L. Wang; et al. Hypochlorous Acid as a Potential Wound Care Agent/Journal of Burns and Wounds, 2007, 6: e5
• Sandin, Rasmus K. B. Karlsson, and Ann Cornell Catalyzed and Uncatalyzed Decomposition of Hypochlorite in Dilute Solutions/Industrial Engineering Chemical Research, 2015, volume 54, issue 15, pp. 3767–3774.
• Daniele S. Lantagne Sodium hypochlorite dosage for household and emergency water treatment/ e-Journal AWWA. 2008, 100 (8).
• Rutala, William A., Weber, David J. Guideline for Disinfection and Sterilization in Healthcare Facilities" (PDF). www.cdc.gov. [2008]
• J. P. Heggers, J. A. Sazy, B. D. Stenberg, L. L. Strock, R. L. McCauley, D. N. Herndon, and M. C. Robson Bactericidal and Wound-Healing Properties of Sodium Hypochlorite Solutions: The 1991 Lindberg Award"/Journal of Burn Care & Rehabilitation, 1991, volume 12, issue 5, pp. 420–424.
Root Canal Irrigants and Disinfectants. Endodontics: Colleagues for Excellence. Published for the Dental Professional Community by the American Association of Endodontists. 2011. —
• Hülsmann, M.; Hahn, W. Complications during root canal irrigation – literature review and case reports" (PDF). International Endodontic Journal. 2000, 33 (3): 186–193. —
• Odabasi, Mustafa Halogenated Volatile Organic Compounds from the Use of Chlorine-Bleach- Containing Household Products/Environmental Science & Technology. 42 (5): 1445–1451.
• Jones, F.-L. Chlorine poisoning from mixing household cleaners/J. Am. Med. Assoc. 1972, 222 (10)
• Minimizing Chlorate Ion Formation in Drinking Water when Hypochlorite is the Chlorinating Agent, American Water Works Association (AWWA) Research Foundation, G. Gordon and L. Adam, Miami University, Oxford, OH & B. Bubnis, Novatek, Oxford
• Emergency Response Plans for Chlor-Alkali, Sodium Hypochlorite, and Hydrogen Chloride Facilities, ed. 7; Pamphlet 64; The Chlorine Institute: Arlington, VA, 2014.
Автор выражает благодарность своему главному ассистенту — научному сотруднику Юстыне за помощь в испытаниях беларуских гипохлоритов и моей украинской parteigenosse Саше aka infiltree за ее нелегкий труд по вылавливанию моих смысловых багов и смешные замечания про тире.Благодарю всех администраторов своего канала, которые провели (и проводят даже сейчас) огромную разьяснительную работу, с невероятной выдержкой, раз за разом объясняя людям какие СИЗ можно использовать, чем дезинфицировать, какой нужен спирт, даже какого размера вирион коронавируса. Ребята — S Sh, Воля, O! Пусть мы не заметны в этом информационном шуме — низкий вам поклон от steanlab. Хотя бы со страниц хабра! В это тяжелое время -Vivat комьюнити LAB-66!
Благодарю всех читателей, которые поддерживают наш канал своими донатами! Без вас ничего бы не вышло!!! Надеюсь я не слишком затянул с написанием, и правильную Белизну еще можно будет найти в магазинах.