
Любая система, какой бы сложной и многослойной она ни была, имеет свой фундамент — основу, без которой она бы не работала так, как работает. В биосфере нашей планеты также имеются базисные кирпичики, на которых все и держится. Ими являются автотрофы — организмы, способные преобразовывать неорганические соединения в органические. Сегодня мы с вами познакомимся с исследованием, в котором ученые из Израиля создали в лаборатории новый вид бактерий, которые питаются углекислым газом. Какие методы были применены в процессе разработки, как вела себя бактерия, и что данный труд может значить для человечества? Об этом мы узнаем из доклада исследовательской группы. Поехали.
Основа исследования
Автотрофы можно назвать одними из самых древних существ на планете. Считается, что первые автотрофы проявились еще два миллиарда лет назад, когда гетеротрофная (не способная синтезировать органику из неорганики) бактерия путем эволюции приобрела способность к фотосинтезу. Сам же термин был предложен в далеком 1892 году немецким ученым Альбертом Бернхардом Франком.

Альберт Бернхард Франк
Некоторые организмы находятся на перекрестке автотрофного и гетеротрофного синтеза, поскольку углерод они получают из органических соединений, а вот энергию из неорганических. Следуя этой логике, автотрофы можно разделить на несколько основных: фототрофы, хемотрофы, радиотрофы, литотрофы и миксотрофы. Существуют также и переходные группы, представителей которых крайне сложно отнести к тому или иному краю спектра синтеза, однако их классификация пока не закончена.
Фототрофы, как намекает нам само название, используют в качестве источника энергии фотоны, точнее солнечную энергии. Именно от этих организмов и происходит такой тип питания как фотосинтез.
Хемотрофам ближе химия, чем физика. Такие организмы используют в качестве источников энергии различные окислительно-восстановительные реакции, т.е. хемосинтез.
Самым же малоизученным и одновременно самым любопытным типом являются радиотрофы — результат феномена под названием «радиостимуляция грибов». Это процесс стимуляции метаболизма микроскопических грибковых за счет ионизирующего излучения. Впервые эти организмы были найдены еще в 1991 году в составе черной плесени, образцы которой были получены из Чернобыльской АЭС. Чуть позднее (в 2006 году) ученые из Нью-Йорка проверили гипотезу радиостимуляции грибов и выявили, что три грибка вида Cladosporium sphaerospermum, Wangiella dermatitidis и Cryptococcus neoformans, которые содержат пигмент меланин, увеличивали свою биомассу и накапливали ацетат (уксусная кислота, CH3COOH) в среде, где уровень радиации превышал норму в 500 раз.
Литотрофы перерабатывают неорганические соединения в необходимые их энергию и углерод посредством аэробного или анаэробного дыхание. Хемолитотрофией могут похвастаться только представители архей (одноклеточных без ядра и мембранных органелл) и бактерий.
Миксотрофы являются универсальными солдатами, поскольку могут одновременно (или поочередно, в зависимости от обстоятельств) использовать сразу несколько разных типов питания, т.е. быть одновременно фототрофами и хемотрофами, например.
Авторы рассматриваемого нами сегодня исследования считают, что более детальное понимание процессов жизнедеятельности автотрофов позволит применить полученные знания в крупных масштабах. И по их мнению, самым лучшим способом изучения автотрофии является создание синтетического автотрофного организма. Теоретически, можно создать бактерию, которая будет питаться углекислым газом. Но назвать этот процесс легким язык не поворачивается. Сами исследователи выделяют три основных этапа, которые необходимо пройти, чтобы их труд был реализован.
Во-первых, для полного перехода к автотрофному питанию, организм должен использовать механизм фиксации СО2 на пути, где входящий углерод состоит исключительно из СО2, а выходными являются органические молекулы, которые вступают в центральный углеродный метаболизм и поставляют все 12 основных предшественников биомассы.
Во-вторых, организм должен применять ферментативные механизмы для получения восстановительной мощности путем сбора нехимической энергии (свет, электричество и т.д.) или путем окислительно-восстановительных процессов, которые не являются источниками углерода.
В-третьих, организм должен регулировать и координировать пути сбора энергии и фиксации СО2, чтобы они совместно поддерживали устойчивый рост, когда единственным источником углерода является СО2.
Ранее уже проводили исследования, в которых пытались создать организм, питающийся СО2, однако в тех работах был один большой изъян — наличие многоуглеродных органических соединений внутри организма, которые служили «запасным» источником питания. Другими словами, создать гетеротрофный организм, который будет брать углерод исключительно из СО2, пока еще не удавалось.
В качестве методологической основы своего исследования ученые использовали цикл Кальвина (цикл Кальвина-Бенсона-Бассама) — серия биохимических реакций при фотосинтезе у растений, цианобактерий и т.д. Этот цикл является самым распространенным механизмом фиксации углекислого газа.
А главным подопытным стала бактерия Escherichia coli, больше известная нам под названием «кишечная палочка».
Результаты исследования
В первую очередь необходимо было провести метаболическую реорганизацию и лабораторную эволюцию организма для реализации перехода к автотрофии. Было рассмотрено несколько соединений-кандидатов, которые могли бы служить донорами электронов для фиксации СО2, что позволило бы бактерии перейти к полной автотрофии.
В качестве источника электронов был выбран формиат*, так как это одноуглеродное органическое соединение может служить источником восстанавливающей части процесса, но не поддерживает рост E. coli естественным образом и не усваивается в биомассу.
Формиаты* — соли и эфиры муравьиной кислоты.Восстановительный потенциал формиата (E0 = 420 мВ) достаточно низок, чтобы уменьшить NAD+ — основной электронный носитель в клетке (E0 = 280 мВ в E.coli). Другое преимущество состоит в том, что он может быть электрохимически получен из возобновляемых источников, а биомасса при этом будет углерод-отрицательной.
Чтобы собрать электроны из формиата и направить их в основной клеточный восстановительный энергетический резервуар NADH (никотинамидадениндинуклеотид), была использована NAD+-связанная FDH (формиатдегидрогеназа) из метилотрофной бактерии Pseudomonas sp.
Стехиометрический анализ (анализ по соотношению масс веществ в химическом соединении) метаболической сети в E.coli показал, что добавления FDH, Rubisco (рибулозобисфосфаткарбоксилаза) и Prk (фосфорибулокиназы) в метаболическую сеть E. coli будет достаточно для автотрофного роста (изображение ниже).

Изображение №1: схема лабораторно модифицированной хемотрофной бактерии E. coli.
К сожалению коэкспрессия трех рекомбинантных ферментов в первичном штамме E. coli (BW25113) не привела к росту в автотрофных условиях. Поскольку стехиометрический анализ не учитывает настройку кинетики фермента, уровень экспрессии и регуляции, было решено использовать адаптивную лабораторную эволюцию в качестве инструмента метаболической оптимизации для достижения автотрофного роста.
Данный метод обусловлен тем, что гетерологичная экспрессия чужеродного ферментативного механизма расширяет пространство возможных метаболических реакций для клетки, обеспечивая возможность автотрофного роста. Проблема заключается в том, что нет никаких гарантий, что необходимый поток будет проходить через недавно расширенный набор реакций.
Следовательно, поскольку центральный метаболизм E. coli адаптирован к гетеротрофному росту, вполне вероятно, что распределение потока, которое поддерживает гетеротрофный рост, будет использоваться. Именно потому и была применена лабораторная эволюция, способная перенаправить поток по желаемому метаболическому пути.
Одними из важнейших процессов лабораторной эволюции является перестройка центрального метаболизма для установления зависимости от потока карбоксилирования Rubisco и адаптация среды роста для подавления потока через изначальные гетеротрофные пути (2A). Другими словами необходимо было заставить бактерию перестать использовать гетеротрофные механизмы метаболизма, переходя на автотрофию.

Изображение №2: схема разработанной эволюционной стратегии для преобразования гетеротрофной бактерии E. coli в хемотрофную.
Прежде всего во время искусственной эволюции были исключены три гена, кодирующих два фермента в центральном углеродном обмене: фосфофруктокиназу (Pfk) в гликолизе и глюкозо-6-фосфат-дегидрогеназу (Zwf) в окислительном пентозофосфатном пути. Первый имеет два изофермента, кодируемых двумя генами (pfkA и pfkB). При выращивании клеток на ксилозе* такая перестройка гарантирует, что рост клеток зависит от карбоксилирования по Rubisco, что и необходимо для перехода к хемотрофии.
Ксилоза* — моносахарид из группы пентоз (C5H10O5).Далее была проведена гетерологическая экспрессия Rubisco, Prk, карбоангидразы (CA), которая преобразует CO2 и бикарбонат, и FDH. Следом за этим идет процесс выращивания клеток в ограниченных ксилозой хемостатах*, которые поддерживают клетки в постоянном углеродном голодании.
Хемостат* — метод культивирования микроорганизмов, когда в питательной среде, где они растут, поддерживается оптимальный баланс и концентрация субстратов.Такая среда культивирования позволяет клеткам пролиферировать (рост тканей путем размножения клеток делением), но замедляет гетеротрофные катаболические* пути.
Катаболизм* — метаболический распад сложных веществ на более простые или окисление вещества (энергетический обмен).Хемостат, где выращивались клетки, также содержал избыток формиата и постоянно продувался обогащенным СО2 воздухом (содержание СО2 10%).
Таким образом, данная среда выращивания замедляет гетеротрофность, заставляя клетки склоняться к автотрофности. Клетки буквально вынуждены уменьшить свою зависимость от внешнего углеродного вклада органического сахара.
Метод выращивания был готов, необходимо было его проверить. Раз в неделю образцы извлекались из хемостатов и проверялись на рост в автотрофных условиях. В частности, это хемоорганоавтотрофные условия для кишечной палочки, которые состоят из среды типа М9 с добавлением 30 мМ (милимоляр) формиата натрия в атмосфере с повышенным содержанием CO2 (10%), но без какого-либо другого источника углерода.
Спустя примерно 200 дней размножения в хемостатах, эквивалентного примерно 150 поколениям, был обнаружен рост в средах, лишенных ксилозы (т.е. в автотрофных условиях). Данный фенотип присутствовал во всех образцах того дня. На 350-ый день ксилоза была полностью исключена из питательной среды (2В). Устойчивый рост и помутнение подразумевали, что в хемостате присутствуют исключительно независимые от ксилозы клетки. Было обнаружено, что образцы нуждались в среде с повышенной концентрацией CO2 для их роста, что предполагает механизм углеродной фиксации.
Далее ученые выбрали один из самых устойчивых в росте клонов* для более глубокого анализа. Было установлено время удвоения* 18 ± 4 часа (2С).
Клон* — в данном случае имеется ввиду группа генетически одинаковых клеток.
Время удвоения* — время, необходимое чему-то увеличиться в размерах в два раза.Необходимо было удостовериться в том, что выращенные клетки действительно автотрофные, а в процессе их роста не было никаких «скрытых» источников углерода или активации гетеротрофного формиата. Для этого были проведены эксперименты по маркированию изотопов.
Для начала эволюционировавшие клоны были выращены в среде с 13С-маркированным формиатом и 13CO2 (10 поколений до получения стабильного изотопного состояния). Далее проводился анализ 13С-меток для разных метаболитов посредством метода жидкостной хроматографии и тандемной масс-спектрометрии.
13С* — углерод-13, стабильный изотоп углерода.
Метаболиты* — продукты метаболизма каких-либо соединений.
Метод жидкостной хроматографии и тандемной масс-спектрометрии* — метод химического исследования, объединяющий в себе жидкостную хроматографию, разделяющую смеси нескольких компонентов, и масс-спектрометрию, обеспечивающую структурную идентичность отдельных компонентов.
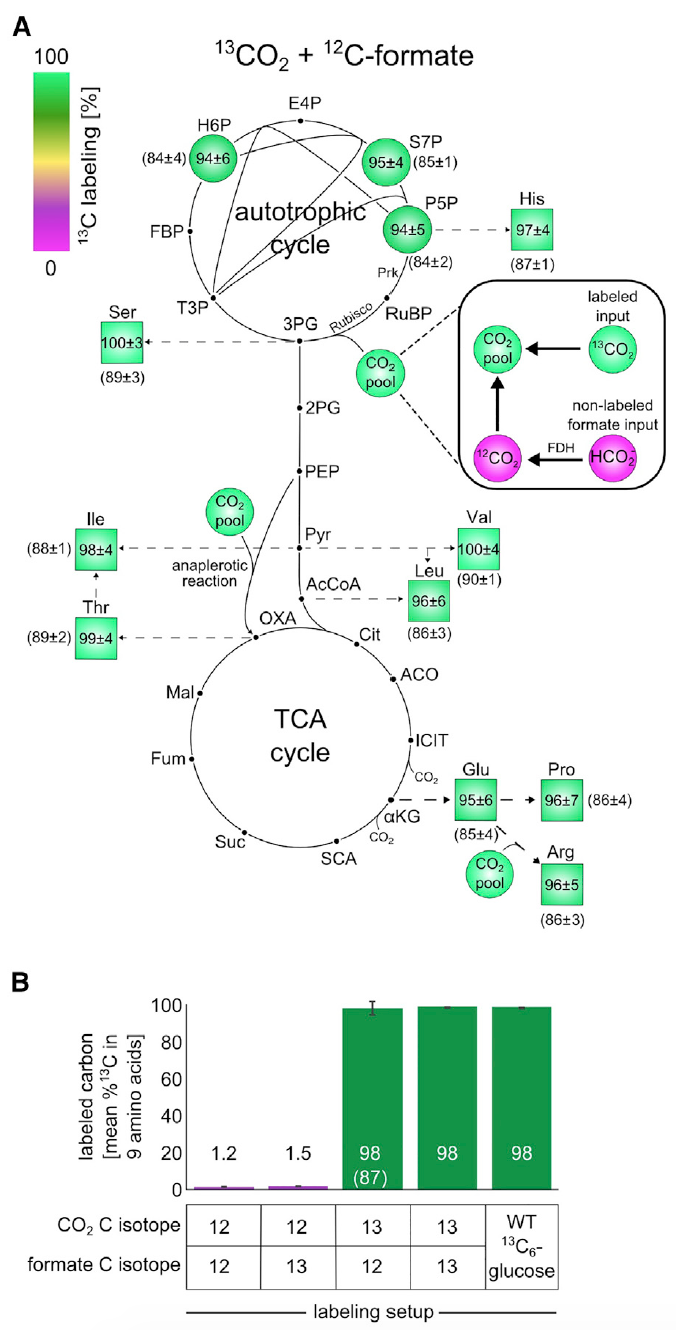
Изображение №3: эксперименты по изотопному маркированию с использованием 13C показывают, что все компоненты биомассы образуются из CO2 в качестве единственного источника углерода.
Анализ показал, что порядка 98% атомов углерода в строительных блоках биомассы центрального метаболизма были успешно маркированы. Эти данные соответствуют маркированному формиату и CO2, содержащих около 99% 13C и 1% немаркированного бикарбоната, растворенного в питательной среде.
Данное наблюдение является неопровержимым доказательством того, что углерод в биомассе клеток происходит именно от СО2 и формиата.
Далее проверялось концентрируется ли формиат в биомассе. Для этого клетки выращивали в среде М9 (концентрация СО2 в атмосфере была 10%, как и в предыдущих опытах) с использованием формиата, помеченного углеродом-13.
Схема маркировки 13С для строительных блоков биомассы после роста в данной среде показали маркировку 13С в пределах 1-2% (3В), что является ожидаемым значением, основанным на естественном содержании 13С и незначительном количестве маркированного формиата. Другими словами, результаты показали, что клетки не ассимилируют формиат.
Совокупность результатов вышеописанных опытов уверенно говорит о том, что источником углерода для выращенных культур являются исключительно СО2 и формиат. А это, в свою очередь, говорит о стопроцентной автотрофии клеток E.coli, прошедших лабораторную эволюцию.
Ученые провели еще один эксперимент для проверки сего утверждения, где применялся маркированный 13СО2 и не маркированный формиат. Ввиду высокой стоимости 13СО2, сосуды, в которых проводился эксперимент, были закрыты. Этот маленький нюанс крайне важен, паскаль из-за закрытой среды (в предыдущих опытах контейнеры проветривались) происходило накопление немаркированного СО2, образованного из-за окисления формиата. А это искажает результаты наблюдений. Тем не менее, процесс «загрязнения» можно было отслеживать и даже корректировать результаты с оглядкой на него, посредством анализа маркированного глутамата.
Данный опыт показал, что около 85-90% атомов углерода в строительных блоках биомассы центрального метаболизма были успешно маркированы. Как видно на изображения 3А и 3В, если применить корректировку по 13С-маркированным компонентом, то маркировка атомов в биомассе будет практически 100%, что говорит об автотрофной природе развития бактерии E.coli.
То, что бактерии стали автотрофами, не поддается сомнениям. Осталось выяснить, какие же генетические изменения, то бишь мутации, произошли в процессе лабораторной эволюции.
Для выяснения этого ученые выделили шесть клонов, способных автотрофно расти на формиате, и провели секвенирование их генома и плазмидов*.
Плазмиды* — молекулы ДНК, физически отделенные от хромосом и способные автономно реплицироваться (процесс создания двух дочерних молекул ДНК на основе материнской молекулы ДНК).Два клона (клон 1 и 2) были выделены, когда ксилоза все еще присутствовала в питательной среде (250-ый день эволюции), три клона (клон 3, 4 и 5) — после того, как ксилоза была исключена из питательной среды хемостата (400-ый день эволюции). Последний клон (клон 6) выделен после размножения одного из ранее выделенных клонов (клон 1) в течение нескольких циклов серийного разведения.
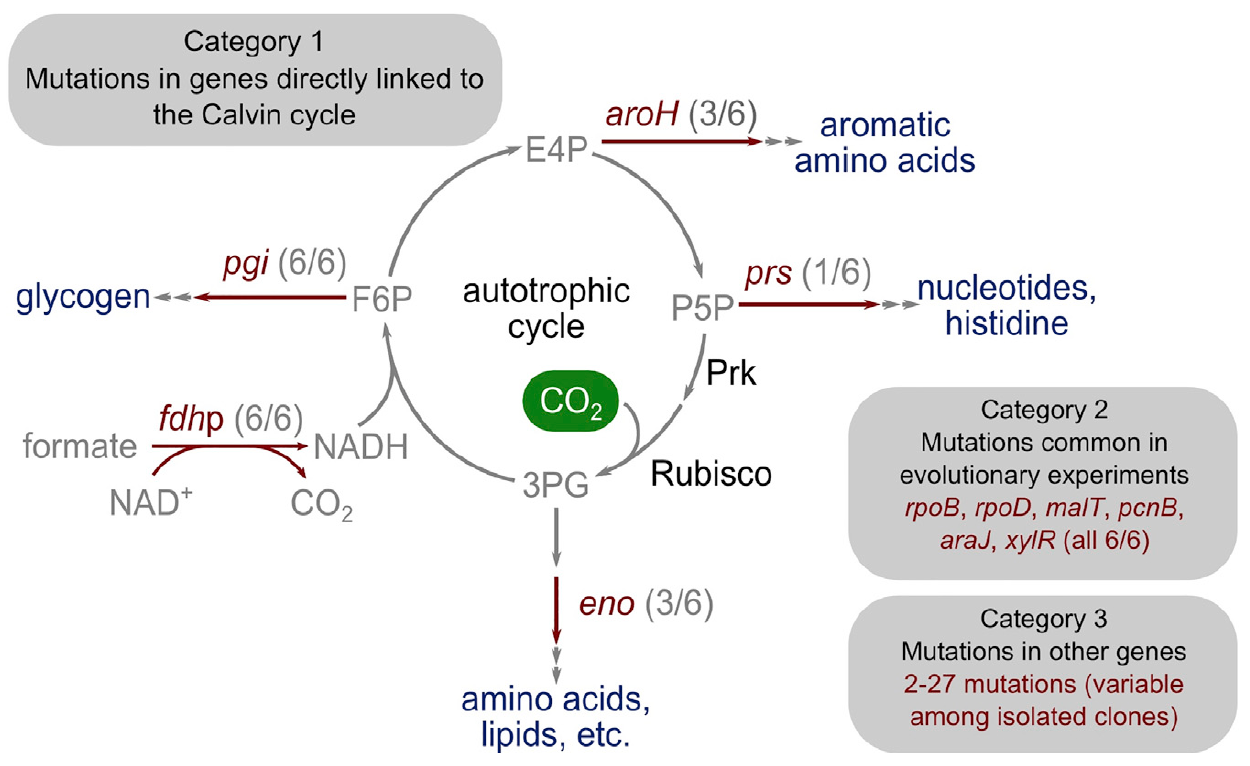
Изображение №4: генетическая основа перехода к автотрофии.
Удивительным было то, что число мутаций было достаточно мало. Исследователи разделили их на три основные категории.
Первая категория состоит из генов, кодирующих ферменты с прямой метаболической связью с функцией цикла Кальвина. Этот ген, который кодирует рибозофосфатедифосфокиназу, направляет рибозофосфат в биомассу.
Вторая категория мутированных генов состоит из тех, которые, мутировали и в предыдущих экспериментах по адаптивной лабораторной эволюции: pcnB (R161P), rpoB (D866E), rpoD (F563S), malT (E359K) и araJ (W156). Данные мутации ученые связывают с самим процессом лабораторной эволюции, то есть они не обязательно связаны с процессом перехода бактерии к автотрофии. Аналогично, была обнаружена мутация в гене xylR, кодирующая регуляторный белок для оперонов, ответственных за катаболизм сахара D-ксилоза (E337K). Она связана с длительным голоданием ксилозы в хемостате во время выращивания, но никак не связана с автотрофией.
К третьей категории мутаций относятся те, которые не имеют характерной роли и могут быть результатом такого явления как «генетический автостоп». В разных изолятах есть где-то от 2 до 27 дополнительных мутированных генов, некоторые из которых могут быть мутациями автотрофного фенотипа, но не являются строго необходимыми для него.
В дальнейшем ученые намерены провести дополнительные исследования генетических мутаций, чтобы определить, какие из них являются основными и необходимыми для перехода бактерии к автотрофии.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В данном исследовании ученым удалось достичь великолепных результатов. Прежде всего стоит отметить лабораторную эволюцию — контролируемый учеными процесс, позволяющий им преобразовать организм по новому «дизайну».
Кишечную палочку буквально заставили путем эволюционных манипуляций стать автотрофом, поглощающим СО2 для обеспечения себя углеродом. Такая бактерия-мутант может быть крайне полезной для общества, страдающего от глобального потепления, одной из причин которого является именно углекислый газ. Однако, как признаются сами исследователи, на данный момент их бактерия при поглощении формиата производит больше СО2, чем поглощает при фиксации углерода. Несмотря на эту «неловкую» ситуацию, считать данный труд ученых бесполезным было бы преступлением. Во-первых, это лишь первые шаги в понимании преобразования гетеротрофных организмов в автотрофные. Во-вторых, дальнейшие исследования позволят выбрать более эффективный источник энергии для бактерий, чем формиат, что значительно снизит выделение СО2. Главное, что фундамент уже заложен, осталось лишь постепенно и очень внимательно вставить кирпичик за кирпичиком.
Бактерия, которая спасет мир от глобального потепления, это звучит невероятно, даже немного научно-фантастично. Но, даже если такую бактерию и создадут, это не снимает с человека ответственности за экологическую ситуацию на планете. Ибо чисто не там, где убирают, а там, где не мусорят.
Благодарю за внимание, оставайтесь любопытствующими, берегите планету и хорошей всем рабочей недели, ребята. :)
Немного рекламы :)
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас:Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Equinix Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
Комментариев нет:
Отправить комментарий