
«Движение это жизнь», — сказала крыша и уехала. Эта шутка довольно «бородатая», но, как и в любой шутке, в ней также есть доля истины. Ведь действительно большинство животных на планете имеют свойство двигаться. В нашей культуре даже существует ряд метафор, крылатых фраз и оборотов, связанных с животными и их движениями: быстрый, как гепард; медлительный, как черепаха; грациозный, словно лань и т.д. Локомоция (т.е. движения) и ее отдельные аспекты у любого существа управляются определенными системами организма, от опорно-двигательного аппарата до центральной нервной системы. Но есть движения, которые ученые ранее не могли связать с каким-то определенным регулятором. К ним относится замирание от страха. Группа исследователей из Колумбийского университета выяснила, что ответственным за «оцепенение» является знакомый всем нам серотонин. Как ученые пришли к этому выводу, почему в опытах участвовали мушки-дрозофилы и какие подробности удалось выяснить? Об этом мы узнаем из доклада исследовательской группы. Поехали.
Основа исследования
И вот опять главным героем исследования становится плодовая мушка, а точнее дрозофила обыкновенная (Drosophila melanogaster). Обусловлено это тем, что это на первый взгляд непримечательное существо обладает рядом уникальных способностей, если можно так выразиться, которые очень ценятся учеными и исследователями.
Прежде чем разбирать по полочкам доклад давайте познакомимся поближе с главной героиней.

Дрозофила фруктовая это двукрылое насекомое, размер которого не превышает 2.5 мм (у самок, самец меньше). Многие из нас знакомы с этими насекомыми не понаслышке. Наступает лето, мы покупаем фрукты и овощи, кладем их где-то в открытом доступе и через некоторое время замечаем, как эти маленькие создания уже облюбовали наши покупки. Если не придавать этому значения, то через несколько дней у вас на кухне будет уже целая армия, способная захватить небольшое государство. Ладно, это гипербола, но их становится реально много (знаю по своему опыту). Для развития дрозофиле многого не надо: достаточно теплая среда и наличие пищи, которая часто служит и местом кладки яиц. Питаются плодовые мушки, как понятно из названия, овощами и фруктами (в дикой природе еще соком деревьев).
Жизненный цикл дрозофилы вполне стандартный: яйцо (24 часа) — личинка (5 дней) — куколка (5 дней) — взрослая особь. При самых благоприятных условиях окружающей среды (температура 25 °C) цикл занимает около 10 дней. То есть, когда вы приносите из магазина фрукты, а через пару дней появляются мушки, знайте — их личинки (или еще яйца) уже были на продуктах. Так что мойте фрукты перед едой.
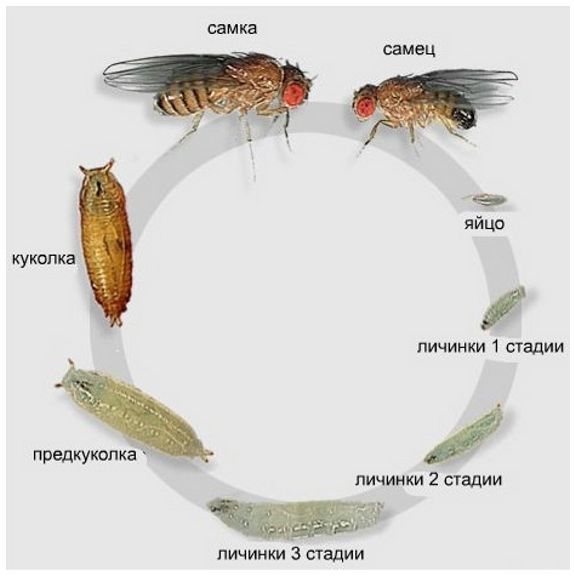
Цикл онтогенеза плодовой мушки.
Как видите, цикл онтогенеза (развития от яйца до взрослой особи) занимает не такое уж и малое время, но дрозофилы компенсируют вероятность потери потомства в этот период количеством отложенных яиц. За всю жизнь самка откладывает порядка 400. При этом она готова к размножению уже спустя 12 часов после завершения своего цикла онтогенеза.
Правильно будет предположить, что ученым дрозофилы интересные не только онтогенезом, но и как многие насекомые, своим методом передвижения и зрением. Крылья мушки плодовой совершают порядка 250 взмахов в секунду. Если вам сложно оценить насколько это много, просто помашите руками и посмотрите сколько таких движений сделаете вы. Для сравнения, колибри (более мелкие виды) совершают порядка 100 взмахов. Также плодовые мушки стали объектом большого интереса генетиков. Уникальные особенности строения генома дрозофилы сделали ее идеальным подопытным в исследовании заболеваний человека (Паркинсона, Альцгеймера). Также дрозофилы помогают в исследованиях иммунной системы человека, онкологических заболеваний, диабета и прочего.
Как видите, это маленькое назойливое создание по своему уникально и обладает большим потенциалом для исследователей.
Дрозофила также идеально подходит и для изучения локомоции. Плодовая мушка, как и многие другие насекомые, обладает достаточно широким спектром движений, которые она выполняет в зависимости от обстоятельств. Для нее не составляет труда перемещаться по сложным поверхностям, в том числе и по потолку вверх ногами. Чтобы такие эквилибристические этюды были возможны, насекомое должно регулировать и скорость движений, и другие кинематические параметры.
В вопросах локомоции между насекомыми и позвоночными, у которых есть конечности, есть общие черты. Одной из таких черт является использование многосуставных ног/лап.
Дрозофила управляет своей сложной походкой посредством нервных цепей в брюшной нервной цепи (далее VNC), которая является функциональным аналогом спинного мозга позвоночных. VNC включает в себя три пары грудных нейромеров (T1, T2 и T3), которые координируют движения трех соответствующих пар ног. VNC получает команды от головного мозга и передает двигательные инструкции через моторные нейроны периферической мускулатуре.
Сенсорные нейроны, которые передают проприоцептивную* и тактильную информацию, проецируют аксоны из придатков в VNC по тем же волокнистым путям, где они разделяются по нейропилям* лапок (1A).
Проприоцепция* — ощущение собственных мышц, то есть осознание положения частей своего тела относительно друг друга и относительно пространства вокруг.
Нейропиль* — скопление отростков нервных клеток.
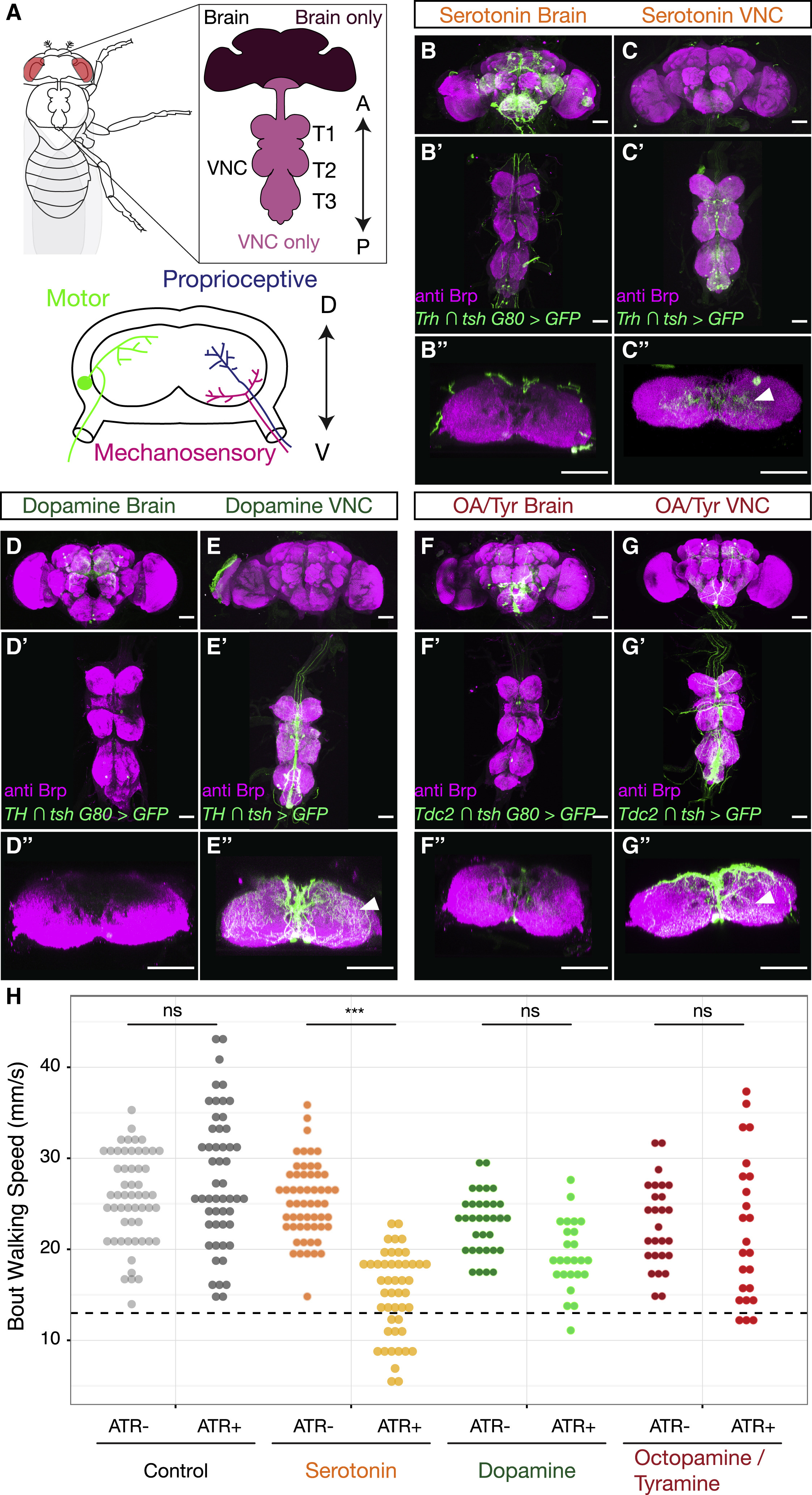
Изображение №1: нейромодуляторы в центральной нервной системе дрозофилы.
Любопытный и немного жутковатый факт — VNC способна выполнять скоординированные движения конечностей даже у обезглавленных животных.
Таким образом, суммируя данные предыдущих исследований, можно предположить, что именно в VNC содержатся нейронные сети, которые могут координировать сгибание и разгибание каждого сустава каждой лапки мухи, а также координировать саму походку.
Ранее было установлено, что для быстрой и устойчивой локомоции крайне необходимы сенсорные данные, исходящие от лапок. Однако нельзя утверждать, что это единственный регулятор, так как даже при удалении проприоцептивных рецепторов или повреждении конечностей скоординированная ходьба не нарушается. Следовательно, есть еще что-то, что ее регулирует. Но что?
Ученые считают, что этими скрытыми регуляторами могут быть нейромодулирующие системы, которые включают в себя дофамин, норадреналин и серотонин.
Нейромедиатор* — вещество, с помощью которого передается электрохимический импульс нервной клетки между нейронами, а также импульс от нейронов к мышечной ткани или железистым клеткам.
Дофамин* — нейромедиатор, который обычно связывают с чувством удовлетворения и любви, а также с когнитивными функциями (переключение внимания с одного этапа когнитивной деятельности на другой). К заболеваниям человека, связанным с дофаминергической недостаточностью, относится болезнь Паркинсона.
Норадреналин* — нейромедиатор, который обычно связывают с бодрствованием. В организме человека участвует в регуляции артериального давления и периферического сосудистого сопротивления. Норадреналин также участвует в реализации реакции «бей или беги», когда организм сталкивается с угрозой.
Серотонин* — тормозящий нейромедиатор, т.е. антипод дофамина (активирующий нейромедиатор). Серотонин вызывает сокращение гладкой мускулатуры и облегчает двигательную функцию, регулирует сосудистый тонус. Также серотонин часто называют «гормоном счастья», что является достаточно грубым и неточным утверждением.Стоит отметить, что одни и те же нейромодулирующие системы выполняют очень схожие функции у разных видов животных. Например, серотонин замедляет двигательные ритмы у миног, котов и саранчи (самое необычное трио, что я видел). Изучение дрозофил показало, что и у них моноаминовые нейромедиаторы* также модулируют широкий спектр поведения.
Моноаминовые нейромедиаторы* — нейромедиаторы и нейромодуляторы, имеющие одну аминогруппу, которая посредством цепи из двух атомов углерода соединена с ароматическим кольцом (-CH2-CH2-).Было установлено, что серотонин влияет на снижение скорости ходьбы, модулирует сон, агрессию и моторное поведение, связанное с тревогой. А вот дофамин, наоборот, связан с гиперактивностью. Еще одним любопытным нейромедиатором является октопамин, который влиял на гиперактивность, вызванную голоданием. В случаях отсутствия октопамина животные передвигались медленнее.
Как мы видим, простое ползание плодовой мушки по стенам или потолку связано с множеством сложных нейрохимических процессов, которые ученые и решили изучить подробнее.
Результаты исследования
Чтобы идентифицировать нейромодулирующие нейроны, которые могут играть роль в модулировании поведения при ходьбе, ученые использовали экспрессию флуоресцентного репортера* с Gal4 под контролем промоторов*, кодирующих ключевые синтетические ферменты для каждой нейромодулирующей системы:
- триптофан-гидроксилаза (Trh) для серотонина (5-НТ);
- тирозин-гидроксилаза (TH или ple) для дофамина;
- тирозин декарбоксилаза 2 (Tdc2) для октопамина и тирамина.
Репортеры* — гены, которые присоединяют к регуляторным последовательностям других генов для исследования проявлений генов в культурах клеток.
Промотор* — последовательность нуклеотидов ДНК, играющая важную роль в процессе инициации транскрипции (синтез РНК, где ДНК выступает в качестве матрицы).Все эти медиаторы демонстрируют обширную экспрессию в клетках как VNC, так и мозга.
Далее ученые проверили, нейроны лапок иннервируются* нейромодуляторные VNC или нисходящими нейронами, происходящими из мозга (1А).
Иннервация* — снабжение органов и тканей нервами, что обеспечивает их связь с ЦНС.Эксперименты показали, что нейромодулирующая иннервация нейропил лапок происходит практически полностью из интернейронов* VNC, а не из нисходящих нейронов в мозге (1B–1G).
Интернейрон* (промежуточный нейрон) — нейрон, связанный только с другими нейронами.Следовательно, именно нейромодуляторные нейроны VNC могут в теории сильно влиять на локомоцию.На следующем этапе исследования ученые проверили, достаточно ли нейромодулирующих нейронов только в VNC для модуляции поведения при ходьбе. Данные нейроны были оптогенетически активированы, а скорость ходьбы была измерена с помощью поведенческого анализа Flywalker.
Анализ показал, что активация исключительно серотонинергических популяций VNC (т.е. без активации допаминергических или октопаминергических / тираминергических) значительно снижала среднюю скорость движения мошек (1H). Базируясь на этом наблюдении, ученые решили сконцентрировать все свое внимание только на серотонинергических нейронах (5-HTVNC).
Для подтверждения теории о серотонине и исключить влияние других нейротрансмиттеров было проведено иммуноокрашивание на маркеры серотонинергических (5-НТ), дофаминергических (TH), октопаминергических / тираминергических (Tdc2), глутаматергических (VGlut), холинергических (ChAT) и ГАМКергических (GABA) нейронов.
Эксперименты показали, что линия Trh-Gal4 управляет экспрессией в 5-HT-экспрессирующих нейронах и что эти нейроны не экспрессируют ни один из других вышеперечисленных нейротрансмиттеров. Следовательно, присутствуют исключительно серотонинергические нейроны.
Далее были проведены практические опыты, где ученые наблюдали за свободно ходящими по камере насекомыми, что позволило охарактеризовать влияние 5-HTVNC-нейронов на двигательные функции.
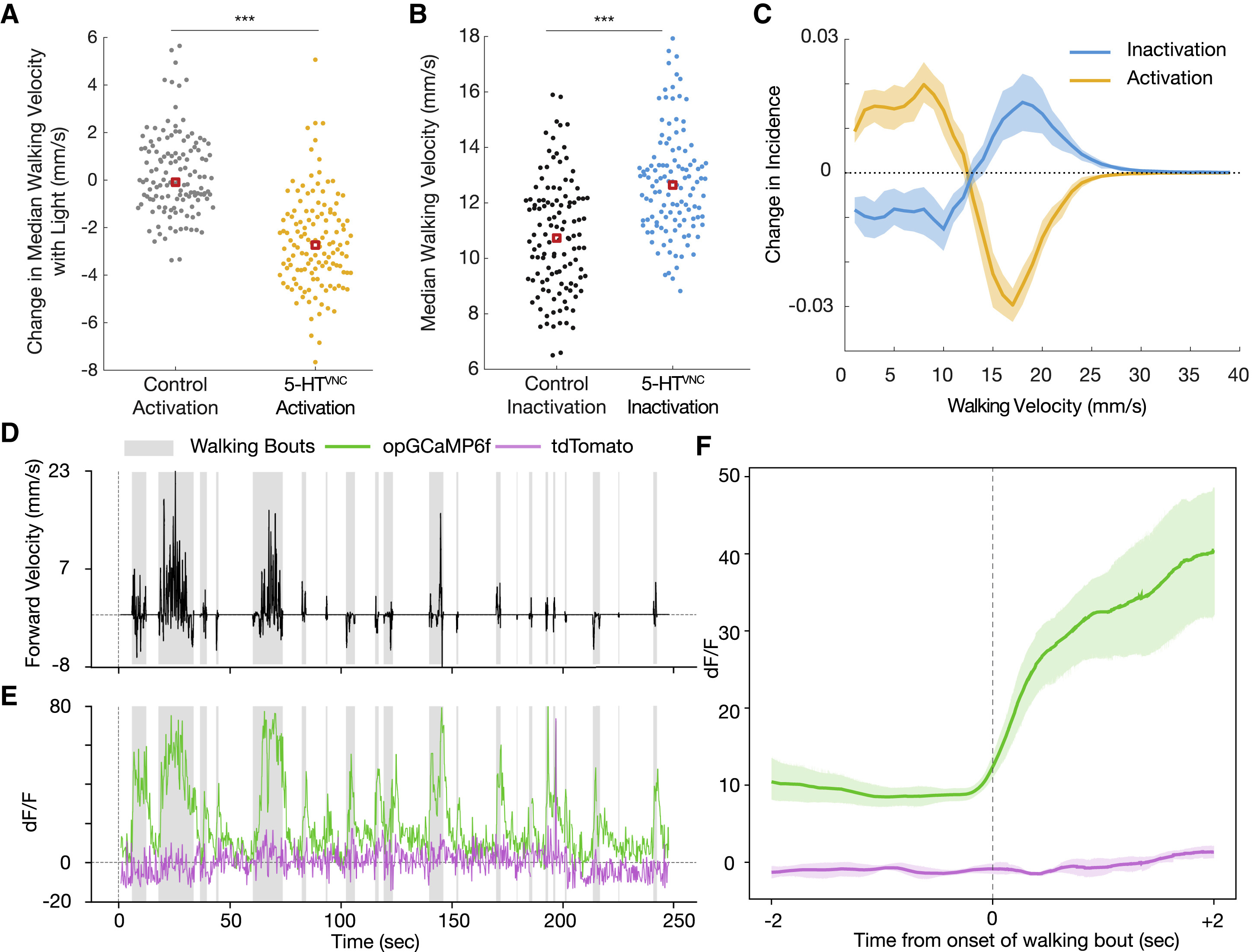
Изображение №2: нейроны 5-HTVNC модулируют скорость ходьбы дрозофилы.
Как и предполагалось, активации 5-HTVNC нейронов было вполне достаточно, чтобы снизить среднюю скорость ходьбы (2А). Любопытно, что активация этих нейронов не меняет общего времени ходьбы подопытных. Это позволяет предположить, меняется не общая активность особи, а именно средняя скорость движения (ходьбы).
Также было обнаружено, что активация 5-HTVNC нейронов уменьшает абсолютную угловую скорость мух. То есть подопытные особи ходят медленнее, но по более прямым траекториям, нежели мошки из контрольной группы.
Ученые отмечают, что данный метод исследования хоть и показывает снижение скорости ввиду активации 5-HTVNC нейронов, но он не может показать в каких ситуациях в реальной жизни (в естественной среде) эти нейроны обычно используются для модуляции локомоции. Чтобы выяснить это, были использованы калиевые каналы внутреннего выпрямления* Kir2.1 для конститутивной инактивации 5-HTVNC нейронов.
Каналами внутреннего выпрямления* называют ионные каналы, через которые положительные ионы легко проходят внутрь клетки, но не наружу.Ингибирование (т.е. «отключение») 5-HTVNC нейронов заставляет мошек ходить быстрее (2В), что лишний раз подтверждает проведенные ранее опыты. Фактически, сдвиги в скорости, вызванные либо оптогенетической активацией, либо конститутивным ингибированием нейронов 5-HTVNC, являются противоположностями друг друга (2С). Кроме того, инактивация 5-HTVNC заставляет подопытных увеличивать их угловую скорость, а также увеличивает процент времени, которое мошка проводит при ходьбе.
Следовательно, взаимное влияние на скорость от активации или инактивации 5-HTVNC нейронов позволяет предположить, что высвобождение серотонина в VNC способно модулировать базовую скорость ходьбы.
Из вышеописанных наблюдений следует, что активация/инактивация 5-HTVNC нейронов будет варьироваться в процессе движения мошки. Для проверки этого мошку поместили на беговую дорожку (нет, это не шутка) и выполнили функциональную кальциевую визуализацию процессов 5-HTVNC (S3А).
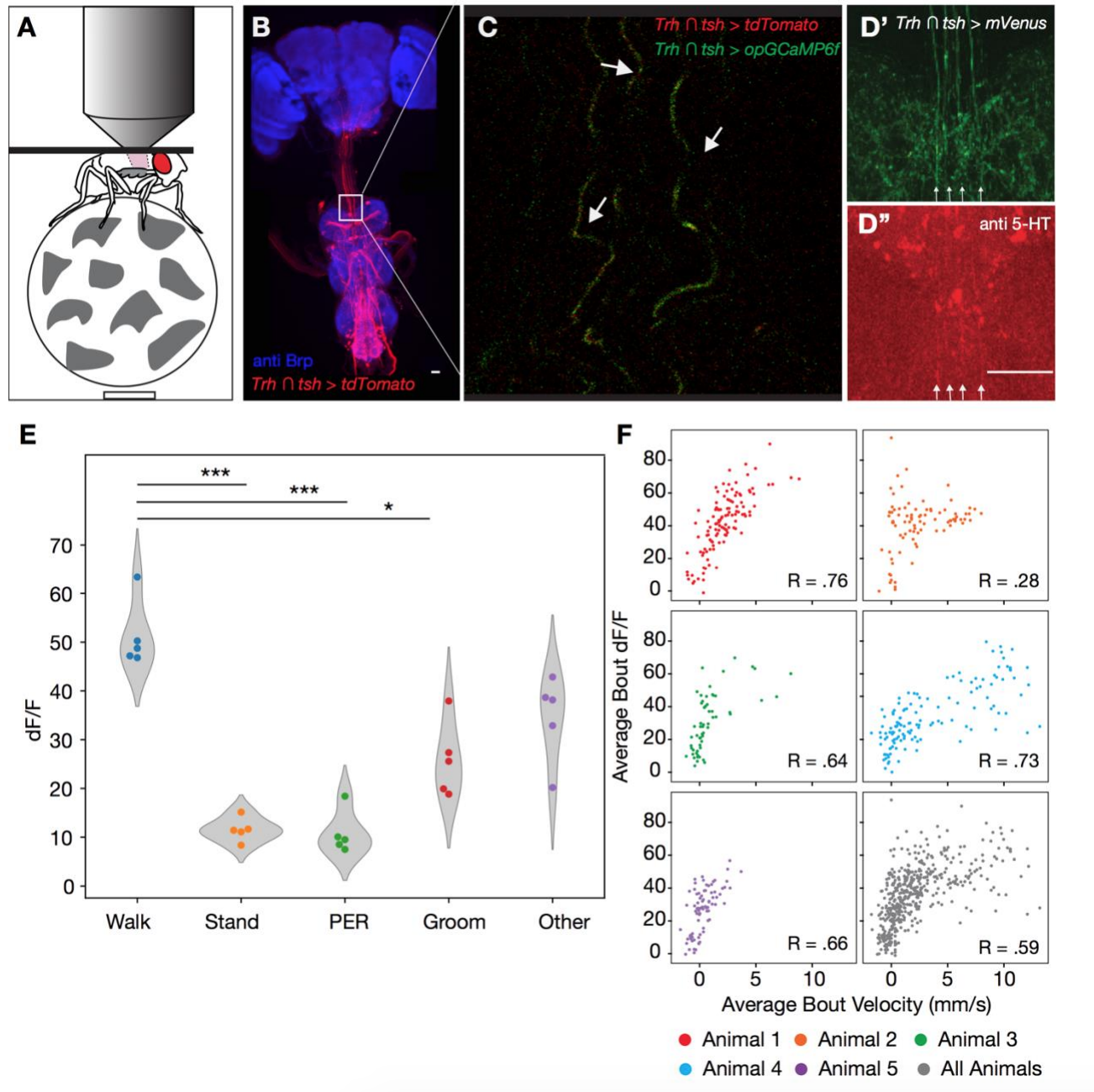
Изображение №S3 (из доп. материалов): визуализация 5-HTVNC нейронов у движущейся мошки (относится к изображению №2).
Анализ проводился не всего тела, а волокон в шейном соединении, поскольку активность в этих волокнах тесно связана с ходьбой (2D и 2E). Флуоресцентные сигналы кальция от этих клеток резко возрастают в начале каждой «прогулки» по беговой дорожке (2F). Эти сигналы намного слабее, когда мошки выполняют другие движения, такие как движения хоботком или «умывание». Эти наблюдения говорят о том, что подмножество 5-HTVNC нейронов являются активными во время ходьбы, а не во время любых движений вообще.
Также было обнаружено, что активность этих серотонинергических процессов положительно коррелирует со средней скоростью ходьбы. Следовательно, эти нейроны могут стать более активными, когда особь идет быстрее.
Однако, можно предположить, что замедление скорости ходьбы при активации 5-HTVNC нейронов может быть обусловлено нарушением координации движений.
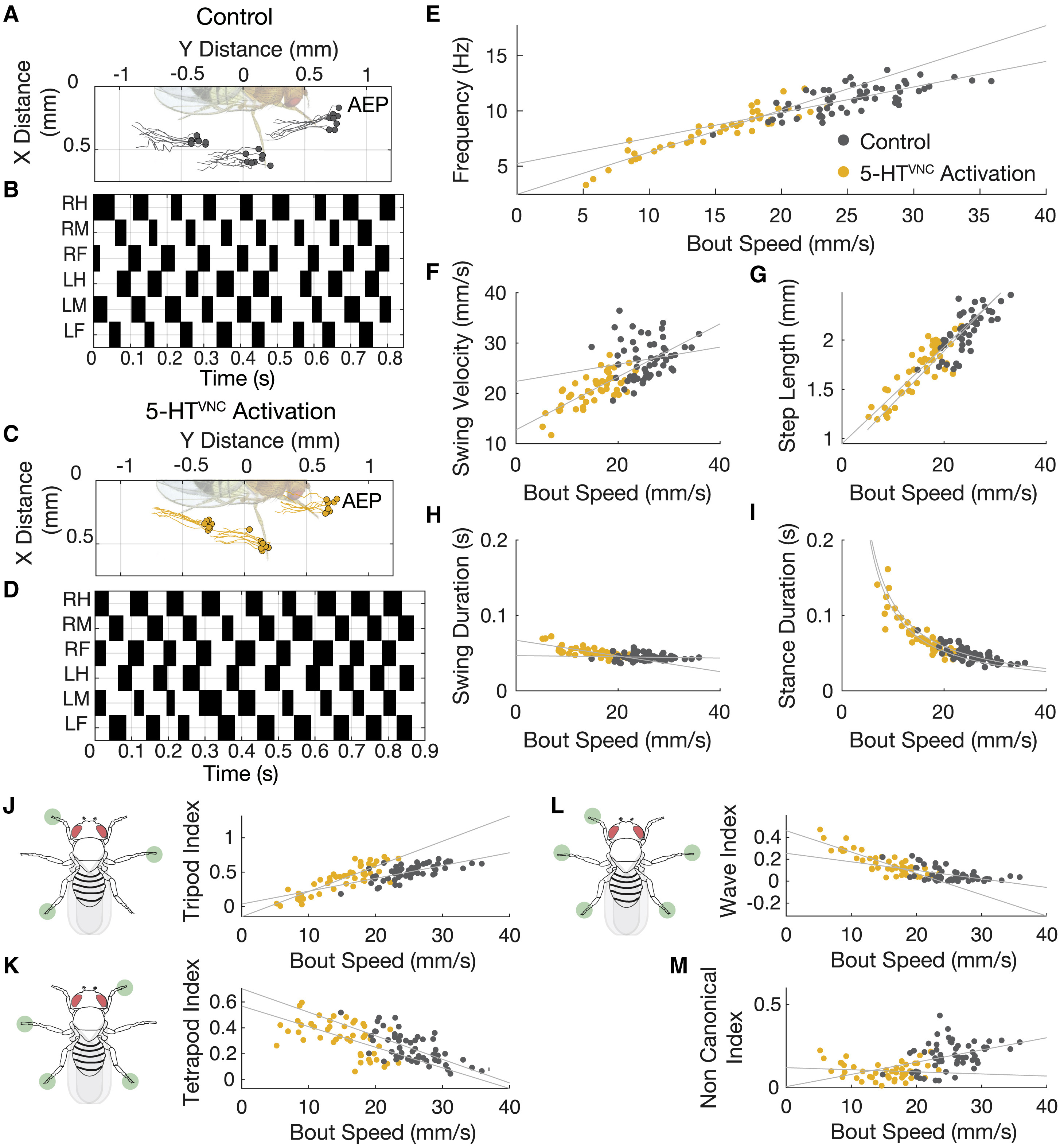
Изображение №3: движения продолжают быть координированными при активации 5-HTVNC нейронов.
В противном же случае, замедление движения и активация 5-HTVNC не связаны с координацией движений. Проверить, какой из вариантов верный можно путем анализа данных Flywalker.
Результаты анализа показали, что активации 5-HTVNC не только не является следствием нарушения координации, а вовсе наоборот. Дело в том, что при более медленной ходьбе требуется большая координация движений, что и было обнаружено у мошек во время опытов (3А и 3С). То, как мошки перемещают каждую из лапок во время ходьбы полностью подтверждают отсутствие каких-либо нарушений координации (3В и 3D). К слову, мошки из контрольной группы (у которых ничего лишнего никто не активировал) как раз таки продемонстрировали менее скоординированные движения, чем мошки с активированными 5-HTVNC нейронами.
Важно учитывать и тот факт, что параметры координации движений и параметры ходьбы не могут быть константой во всех случаях, так как они постоянно меняются в зависимости от скорости движения животного. Например, когда животные ходят медленнее, частота их шага уменьшается, они делают более длинные шаги и замедляют скорость своих раскачивающихся (т.е. в момент совершения шага) лап. Такие смещения параметров сопровождаются смещениями в пошаговом цикле, поскольку длительность стойки (отдельного положения тела во время ходьбы) увеличивается, а длительность колебания остается в основном неизменной.
Когда нейроны 5-HTVNC активируются, эти отношения остаются актуальными и распространяются на диапазон более медленных скоростей (3E-3I). Когда мошка замедляет шаг, она преимущественно использует 4 лапки для опоры (более устойчивый вариант), тогда как при быстром шаге используется три. После активации 5-HTVNC нейронов подопытные продолжают использовать именно такую походку (3J-3L).
В некоторых случаях, таких как длина шага (3G) и продолжительность стойки (3I), отношение между параметрами движений и скоростью при активации нейронов является экстраполяцией соответствующего отношения у диких мошек. А вот в случае выбора походки с применением опоры из трех лапок (3J) отношение параметров и скорости изменяется при активации этих нейронов. Другими словами длина шага и продолжительность отдельного положения во время ходьбы при активации 5-HTVNC сопоставимо с обычными мошками, а в случае походки типа «тренога» отношение параметры-скорость меняется.
Как уже стало понятно, серотонергическая система используется для регулирования скорости ходьбы: когда система активирована, мошки ходят медленнее, а когда система инактивируется, мошки ходят быстрее. Следуя этому утверждению, ученые решили проверить нужна ли данная система для корректировки базовой скорости ходьбы естественным образом.
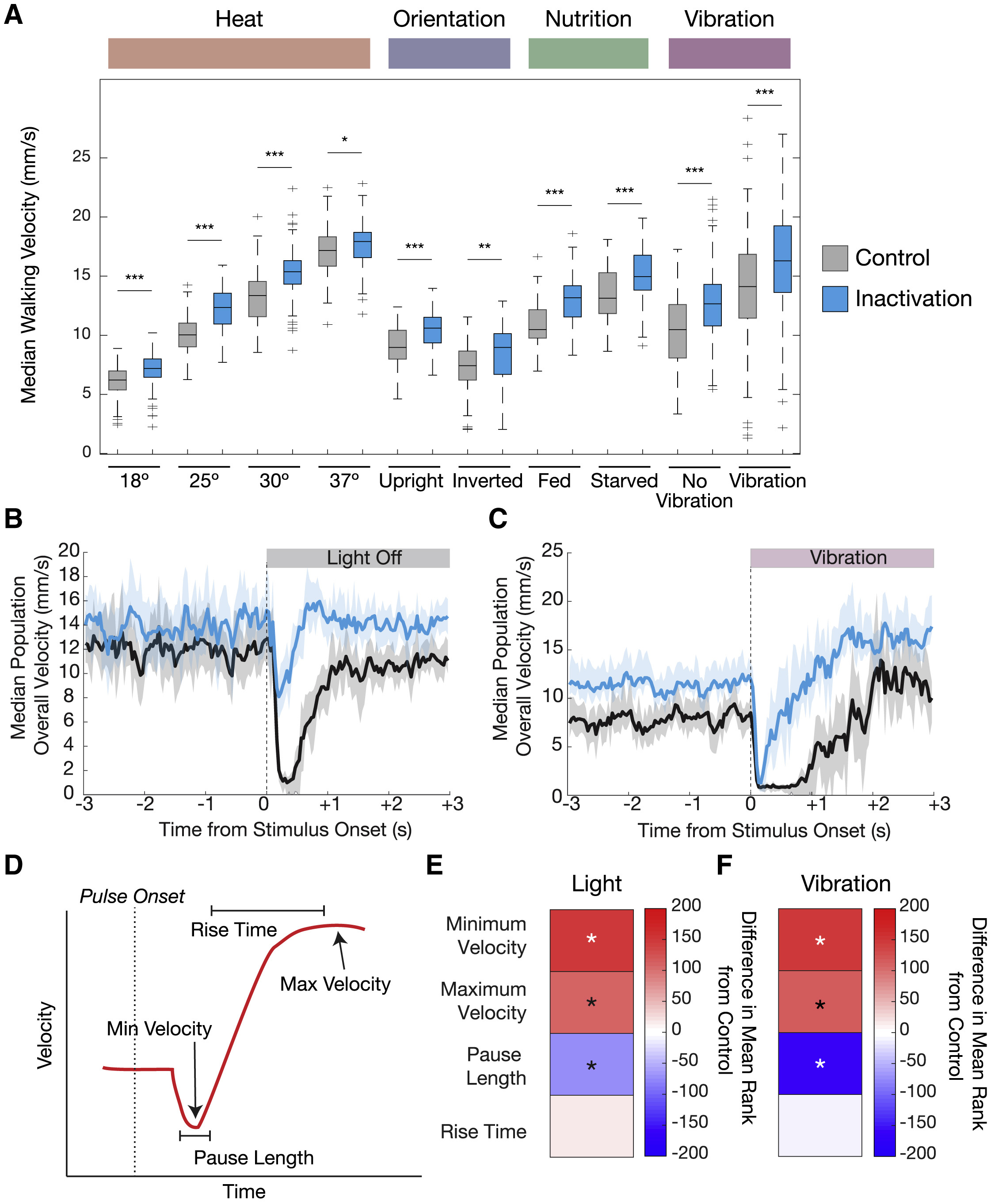
Для проверки этого было проведено несколько опытов, когда 5-HTVNC нейроны были инактивированы, а среда пребывания мошек содействовала разным скоростям движения (изменение температуры, ориентация положения тела, доступность пищи и механосенсорная стимуляция).
Любопытно, но все подопытные с неактивными нейронами 5-HTVNC продолжали успешно регулировать свою скорость (4А).
Изображение №4: изменения параметров ходьбы, когда нейроны 5-HTVNC были неактивны.
Было выявлено, что во всех тестируемых условиях подопытные, у которых 5-HTVNC-нейроны были неактивны, ходят быстрее, чем контрольная группа. К примеру, мухи ходят медленнее при 18 °C и быстрее при 30 °C, даже когда нейроны 5-HTVNC отключены.
Таким образом, выброс серотонина в VNC замедляет скорость ходьбы в широком спектре условий окружающей среды. Эти результаты согласуются с моделью, в которой серотонинергическая система VNC действует как мягкий и конститутивный модулятор скорости ходьбы, независимо от того, насколько быстро или медленно эта скорость устанавливается другими механизмами.
Самым же любопытным наблюдением стало то, что инактивация 5-HTVNC нейронов влияет на реакцию мошки в ответ на резкие изменения в окружающей среде. Хотя приведенные выше результаты показывают, что серотонинергическая система VNC не нужна мошкам для регулировки базовой скорости ходьбы во многих ситуациях, испуг является достаточно уникальной ситуацией, которую следует изучить.
У млекопитающих классическое поведение испуга возникает в ответ на широкий спектр сенсорных стимулов — акустических, тактильных, вестибулярных и т.д. Данные реакции протекают невероятно быстро и включают в себя одновременное сокращение мышц по всему телу. Как и млекопитающие, дрозофилы проявляют классическое поведение во время испуга — замирание на доли секунды, а потом спасительное отступление.
Для проверки связь замирания, серотонина и активности 5-HTVNC нейронов было проведено несколько опытов по двум сценариям: резкая темнота и резкая вибрация. В обоих сценариях подопытные демонстрируют две поведенческие реакции (4B, 4C и 4D): сначала многие их особей практически полностью замирают (на 0.25 секунды), затем следует небольшая пауза (около 1 секунды), а потом мошка начинает действовать в соответствии с новыми обстоятельствами.
Следовательно, серотонинергическая система не только служит конститутивным фактором изменения локомоторной скорости, но и является модулятором замирания независимо от стимула, вызвавшего у мошки испуг.
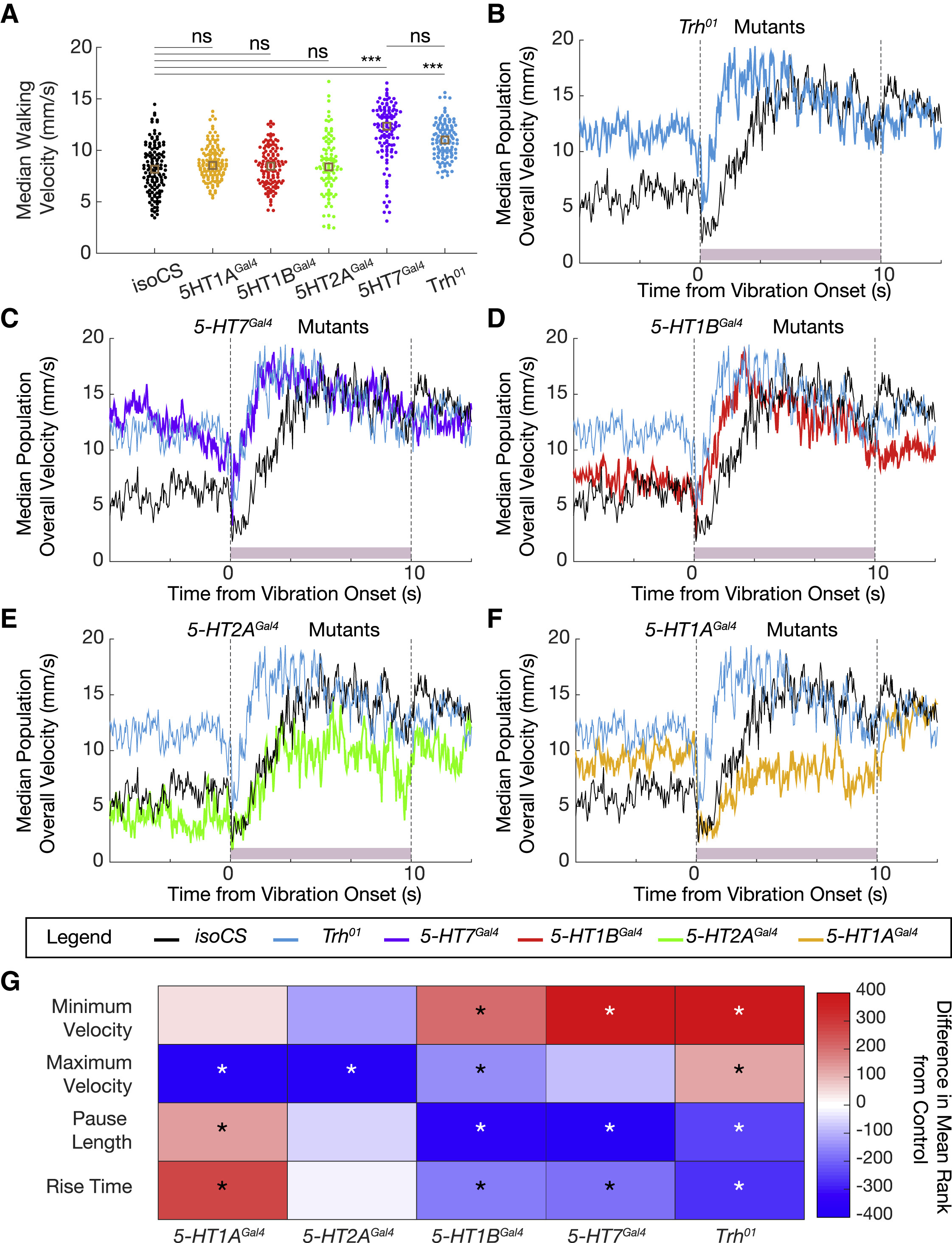
Исследователи напоминают, что все пять серотонинергических рецепторов у дрозофилы — 5-HT1A, 5-HT1B, 5-HT2A, 5-HT2B и 5-HT7 — являются рецепторами, связанными с G-белком (GPCR). Все эти рецепторы могут по-разному влиять на локомоцию и на ответные реакции ввиду испуга.
Особи с рецептором 5-HT1AGal4, 1BGal4, 2AGal4 и 7Gal4 больше времени проводят при ходьбе, однако скорость ходьбы увеличивается лишь у особей с 5-HT7Gal4 (5А). Из этого следует, что 5-HT7 является основным рецептором, ответственным за опосредованное влияние серотонина на скорость ходьбы.
Изображение №5: влияние серотонинергических рецепторов на параметры локомоции.
Далее было проверено влияние рецепторов на ситуацию с резкой вибрацией. 5-HT7Gal4 и 5-HT1BGal4 практически полностью копируют реакцию замирания, наблюдаемую у Trh01, а также в экспериментах по инактивации 5-HTVNC (5C, 5D и 5G). А вот 5-HT1AGal4 и 5-HT2AGal4 не показывают резкого изменения продолжительности паузы, но демонстрируют устойчивое снижение конечной скорости особи в ответ на внешний стимул (5E-5G). Из этих наблюдений следует, что разные рецепторы валяют на разные аспекты реакции испуга.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В данном исследовании было показано, что серотонин имеет прямое влияние на локомоцию, а также на реакцию испуга. Ученые считают, что серотонин в момент испуга действует, как аварийная система, которая вызывает сокращение тканей в конечностях мошки, что вызывает последующую короткую паузу перед началом движения. Данная пауза может играть важную роль, поскольку в этот момент нервная система может собрать дополнительную информацию о стимуле, вызвавшем испуг, и принять решение, как стоит действовать дальше.
Эксперименты проводились над дрозофилами, однако результаты наблюдений могут быть применены для анализа химических и молекулярных процессов у других животных, в том числе и людей, поскольку серотонин и реакция оцепенения крайне широко распространены среди животных самых разных видов.
В дальнейшем ученые планируют детальнее изучить влияние серотонина на локомоцию, а также установить другие факторы, которые тем или иным образом модулируют движения животных. Главной задачей для себя исследователи называют создание полной молекулярной карты процессов, связанных с локомоцией.
Идешь себе по лесу, никого не трогаешь, а тут твой двойник.
Благодарю за внимание, оставайтесь любопытствующими и отличных всем выходных, ребята! :)
Немного рекламы :)
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас:Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Equinix Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
Комментариев нет:
Отправить комментарий